
20.工业生产纯碱的工艺流程示意图如下:
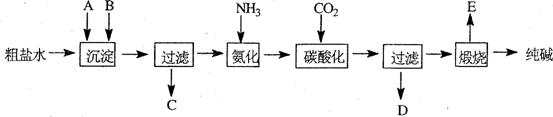
1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。 A B
2)实验室提纯粗盐的实验操作依次为:
取样、 、沉淀、 、 、冷却结晶、 、烘干。
3)工业生产纯碱工艺流程中,碳酸化时产生的现象是 。
碳酸化时没有析出碳酸钠晶体,其原因是 。
4)碳酸化后过滤,滤液D最主要的成分是 (填写化学式),检验这一成分的阴离子的具体方法是: 。
5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:
滤液D加石灰水前先要加热,原因是 。
6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
(注明你的表达式中所用的有关符号的含义)
19.硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式 ;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 。
(2)测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜品体受热可以逐步失去结品水,温度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
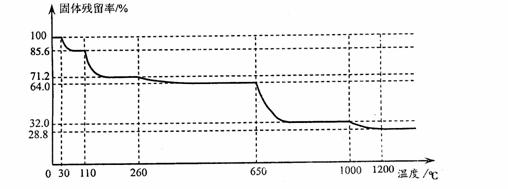
在110℃时所得固体的成分为 ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为 。(填字母)
A.0 mol B.0.1mol C.0.125mol D.大于0.125mol
18.多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如下。已知常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。 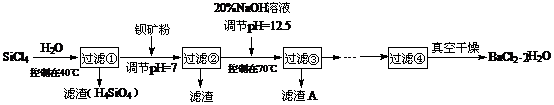 (1)SiCl4水解控制在40℃以下的原因是 。
(1)SiCl4水解控制在40℃以下的原因是 。
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) ΔH2=189 kJ/mol
则由SiCl4制备硅的热化学方程式为 。
(2)加钡矿粉时生成BaCl2的离子反应方程式是 。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是 ,控制温度70℃的目的是 。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到·2H2O。实验室中蒸发浓缩用到的含硅酸盐的仪器有 种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是 。
17.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
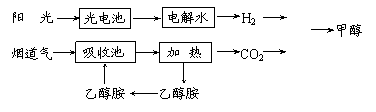
⑴ 该合成路线对于环境保护的价值在于 。
⑵ 15-20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因: 。
⑶ CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
⑷ 科学家发明了一种廉价光电化学电池装置,其电极材料是目前应用最多的半导体材料Si,甚至有人提出硅是“21世纪的能源”,硅可作为新能源的原因可能的是 。
a.在自然界中存在大量的单质硅
b.硅可以通过化学方法“再生”
c.硅具有较强的亲氧性,燃烧放出的热量多
d.硅的化学性质不活泼,便于安全运输、贮存
⑸工业生产硅(粗)的主要原理为:SiO2+2C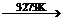 Si(粗)+2CO↑。
Si(粗)+2CO↑。
在制硅(粗)的过程中同时会有碳化硅生成,若产物硅和碳化硅的物质的量之比为1:1,则参加反应的C 和SiO2的质量比为________________。
16.硅酸盐在自然界中分布极广,几乎在所有的硅酸盐矿物中,Si原子都和4个O原子结合成四面体的[SiO4]单元(图1),图中○表示“O”,⊙表示“Si-O”),[SiO4]单元既可以是分立的,也可以和其它四面体共用顶点连接各种各样的链状结构(如图2)、环状结构(图3)

(1)形成硅氧四面体是硅与氧成键的一个重要特征,试再举两种含有[SiO4]单元的物质(要求不同种类) 。
(2)最简单的硅酸盐是硅酸钠,硅酸钠溶液中滴入酚酞显红色,用离子方程式解释其原因 ,通入CO2能使溶液的红色褪色,离子方程式 。
(3)将某些盐混进硅酸钠溶液时,盐会向上扩散长成很漂亮的树状,且树会保留金属离子的特征颜色,例如:CuSO4·5H2O和Na2SiO3溶液发生水解反应长成蓝色的树,NiSO4·7H2O则会长成绿色的树,写出加入CuSO4·5H2O长成蓝树的离子方程式: 。
(4)图1为SiO44-,图2、图3所示硅酸盐离子的符号 、
(5)由13个正四面体结合成的环状结构Si13O3722-离子中,其中有 个正四面体和另外的四面体共享2个顶点。
15.单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
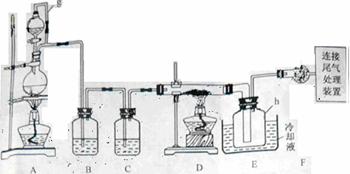
 a.四氯化硅遇水极易水解;
a.四氯化硅遇水极易水解;
 b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
 c.有关物质的物理常数见下表:
c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
163 |
 (1)写出装置A中发生反应的离子方程式
。
(1)写出装置A中发生反应的离子方程式
。
 (2)装置A中g管的作用是
;装置C中的试剂是
;装置E中的h瓶需要冷却理由是
。
(2)装置A中g管的作用是
;装置C中的试剂是
;装置E中的h瓶需要冷却理由是
。
 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(填写元素符号)。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(填写元素符号)。
 (4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:

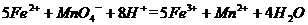
 ①滴定前是否要滴加指示剂?
(填“是”或“否”),请说明理由
。
①滴定前是否要滴加指示剂?
(填“是”或“否”),请说明理由
。
 ②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是
。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是
。
14.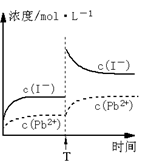 取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s) =R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。结合上述实验数据(已知lg2=0.3),下列有关说法正确的是
取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s) =R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。结合上述实验数据(已知lg2=0.3),下列有关说法正确的是
A.常温下,0.0025mol/LNaOH溶液 pH=11.4
B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,
PbI2的Ksp减小
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI
浓溶液,离子浓度变化如右图所示。
D.本次实验测得的t℃ PbI2的Ksp=4×10-9
13.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
|
选项 |
操作及现象 |
溶液 |
|
A |
通入CO2,溶液变浑浊。再升高至65℃以上,溶液变澄清。 |
C6H5ONa溶液 |
|
B |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 |
Na2SiO3溶液 |
|
C |
通入CO2,溶液变浑浊。再加入品红溶液,红色褪去。 |
Ca(ClO)2溶液 |
|
D |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊。 |
Ca(OH)2溶液 |
12.下表中的实验操作能达至实验目的或得出相应结论的是
|
选项 |
实验操作 |
实验目的或结论 |
|
A |
向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加0.01mol·L-1NaCl溶液,至不再有沉淀生成,再向其中滴加 0.01mol·L-1Nal溶液,产生黄色沉淀。 |
常温下,Ksp(AgCl)>Ksp(Agl) |
|
B |
C2H5Br与NaOH溶液混合充分振荡,再加入AgNO3溶液 |
检验C2H5Br中的溴元素 |
|
C |
向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 |
说明溶液中一定含有Fe2+ |
|
D |
将少量某物质滴加到新制的氢氧化铜悬浊液中,加热后有红色沉淀生成 |
说明该物质一定是醛 |
11.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是
|
|
50 mL盐酸 |
50 mL盐酸 |
50 mL盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0mol/L
B.根据表中数据能计算混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com