
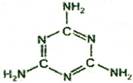
 1. 2008年9月,中国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因是奶粉中含有三聚氰胺。三聚氰胺也被人称为“蛋白精”,价格便宜。牛奶和奶粉添加三聚氰胺,主要是因为它能冒充蛋白质。三聚氰胺的结构如右图,下列关于三聚氰胺的说法错误的是
1. 2008年9月,中国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因是奶粉中含有三聚氰胺。三聚氰胺也被人称为“蛋白精”,价格便宜。牛奶和奶粉添加三聚氰胺,主要是因为它能冒充蛋白质。三聚氰胺的结构如右图,下列关于三聚氰胺的说法错误的是
A.有机物 B.无机物
C.化合物 D.分子式为C3N6H6
(4)若碘溶液体积为VamL.,浓度为Cmol?L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: VSO2%=22.4CVa/(22.4CVa+Vb)×100%(其它合理答案也给分)。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. bceg或beg或ceg选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
启普发生器、启普发生器变形装置、气体量取装置、防倒吸安全装置都利用了气压原理
挑战性问题:1利用Cu与浓HNO3的反应设计一个蓝色喷泉。
(1)烧瓶中加入4ml浓HNO3,塞上带长导管的软木塞(在导管上靠近软木塞处缠绕粗铜丝)
(2)长导管上另有一橡皮塞(配一盛水的上部有一破洞的塑料瓶)
(3)将烧瓶缓缓倒置,另一橡皮塞塞入塑料瓶
(也可以用热毛巾等的方法使水升入
烧瓶而不用有破洞的瓶子)
2现有一烧瓶的Cu(OH)2的悬浊液,请用漏斗烧杯常用仪器
设计一个不需添加的自动过滤器.
27.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等N2、O2的体积的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失卮,没有及时停止通气,则测得的SO2含量偏低 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用酸性高锰酸钾溶液或溴水 代替(填写物质名称)。
(2003年全国理综)33.(22分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀H2SO4、铁屑 。
(2)除去蒸馏水中溶解的O2常采用 煮沸 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是避免生成的 Fe(OH)2沉淀接触O2。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是稀 H2SO4 铁屑 。
(2)在试管Ⅱ里加入的试剂是 NaOH溶液 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入 。
(2003年上海高考题)
(4)如果实验中得到的氧气体积是c L(25 ℃、1.01×l05 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)= 4分
(2002年全国理综)
图1 图2
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用向下排空气 法,要得到干燥的氨气可选用碱石灰 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是打开止水夹,挤出胶头滴管中的水 。该实验的原理是氨气极易溶解于水,致使烧瓶内气体压强迅速减小 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
答:打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
20.(13分)某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性?_将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。(3分)。
(2)以下是测量收集到气体体积必须包括的几个步骤;①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:_②①③(3分)(请填写步骤代号)
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
_慢慢将量筒下移。(3分)。
的量总是小于0.15mol,其可能的主要原因是 随着反应进行浓盐酸浓度下降,到一定程度反应就不能进行 。(假定各步反应均无反应物损耗且无副反应发生)
六、气压问题
(2001年全国高考)
A B C D E F
⑴选用各装置的接口顺序为 adig
⑵各装置所起的作用 A制备Cl2 D制漂白粉 F尾气处理
⑶实验中若用12mol?L-1的浓盐酸100ml与足量的MnO2反应,最终生成Ca(ClO)2的物质
9.实验验证水的组成中H、O元素的物质的量之比为2:1
1电解法:用水电解器电解稀NaOH溶液,比较阴阳两极产生气体的体积比。
2 H2+CuO=Cu+H2O 再用碱石灰吸收生成的水,根据CuO减少的质量和碱石灰增加的质量求H、O元素的物质的量比
3燃烧法:取一定体积H2燃烧,吸收生成的水,根据H2与H2O的关系计算
4燃烧法:取一定质量的苯完全燃烧,收集生成的水
根据苯的质量求出H的量,再用H2O的质量减去H的质量求出O的量,求比值
五、实验装置组合
5计算M=22.4×(m2-m1)/V
方法四:
1Na2CO3与过量盐酸分别称重,反应后再称重,测产生气体的质量;
2通过Na2CO3可知CO2的物质的量
3求摩尔质量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com