
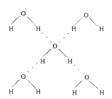
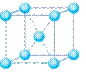
 (5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
六.(本题包括1小题,共10分)

A B C D E
21.(12分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为__________;
(2)写出与H2O分子互为等电子体的微粒__________。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
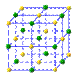
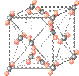
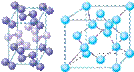
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)

请回答下列问题:
(1)写出物质B的电子式 ;
(2)比较①~⑦七个反应,请归纳它们的共同特点是 ;
(3)写出反应⑦的化学方程式 ;
(4)写出过量A与H浓溶液反应的离子方程式 ;
(5)D是实验中常用的物质,检验D是否变质的方法是:
。
五.(本题包括1小题,共12分)
20.(10分)已知A为常见金属,常温下X、E、F为气体,C为液体。B是一种盐,受热易分解,冷却时分解产物又能化合生成B,B在工农业生产中有着广泛的用途。有关物质之间的转化关系如下图(其中有些反应的条件及部分生成物被略去):
(4)在T℃时,相同容器中,若开始时加入0.2 mol A 、0.8 mol B 、0.9 mol D 、0.5 mol E反应,达到平衡后,A的浓度范围为_______________________。
(5)下面四个选项是四位学生在学习化学反应速率与化学反应限度以后,联系化工生产实际所发表的看法,你认为不正确的是_______
A、化学反应速率理论可指导怎样在一定时间内快出产品;
B、有效碰撞理论可指导怎样提高原料的转化率;
C、勒夏特列原理可指导怎样使用有限原料多出产品;
D、正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益。



(1)据图1所示,反应开始至达到平衡时,用D表示该反应速率为_____mol/L?min;
(2)该反应的化学平衡常数K的数值为_________________(保留至两位小数);
(3)反应达到平衡后,第7 min时:
①若升高温度,D的浓度变化最可能的是_____(用图2中a~c的编号回答);
②若将容器的容积压缩为原来一半,请在图3中画出7 min后D浓度变化情况。
mA(g)+nB(g) pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。
pD(g)+qE(s),DH<0(m、n、p、q为最简比例的整数)。
19.(10分)在某个容积为
(1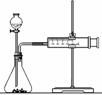 )该同学的实验目的是________________________________;
)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图
装置进行定量实验。完成该实验应选用的实验药品是______;
应该测定的实验数据是____________________________。
实验二:已知2KMnO4+5H
(1)针对上述实验现象,某同学认为KMnO4与H
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是____
A、硫酸钾 B、硫酸锰 C、氯化锰 D、水
四.(本题包括2小题,共20分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com