
或S2-+2H2O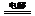 S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2;
(2分)
S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2;
(2分)
(2)阳离子(Na+),钛(或石墨); (2分) (3)4, 正四面体。 (2分)
Fe3++H2S = S↓+2Fe2++2H+, (2分) Na2S+2H2O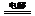 S↓+H2↑+2NaOH (2分)
S↓+H2↑+2NaOH (2分)
18.(10分)请回答下列化工知知识.
(1)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 ________________________________;如果用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为 _________________________,该方法的优点是________________________;
(2)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。阳离子膜和隔膜均允许通过的
分子或离子是______________,电解槽中的阳极材料为 ____________________;
(3)第ⅢA、VA元素组成的化合物GaN、GaP、CaAs等是人工合成的新型半导体材料,
其晶体结构与单晶硅相似。在GaN晶体中,每个Ga原子与____________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为_____________。
(3)存在:溶液中肯定存在离子是NH4+、CO32-和SO42-。经计算,NH4+的物质量为0.05mol,CO32-、SO42-的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在(每空1分)
0.2
0.1
CO32-
第一次称量读数为6.
试回答下列问题:
(1)根据实验1对C1―是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验1―3判断混合物中一定不存在的离子是 。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号
物质的量浓度(mol?L―1)
(3)试确定K+是否存在? ,判断的理由是
。
(1)不能确定:Ba2+、Mg2_
(2)
阴离子符号
物质的量浓度(mol?L―1)
SO42-
收集到气体
3
加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量
17.(7分)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、C1―、NH4+、Mg2+、Ba2+、SO42―、CO32CO32―。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
实验序号
实验内容
实验结果
1
加AgNO3溶液
有白色沉淀生成
2
加足量NaOH溶液并加热
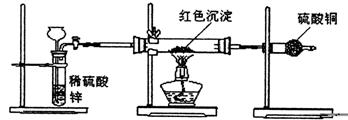
(4)研究性学习小组丙上网查阅新闻得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”。绿色化学强调对环境友好,实现零排放。“变废为宝”符合绿色化学要求。他们收集上述红色沉淀制备化学试剂――蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案:_________________________。(1)确保氢氧化钠过量(2)红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜);方案3
(3)②③⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com