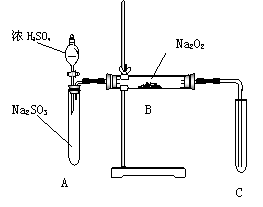
 21、(13分)化学兴趣小组同学运用类比学习的思想, 探究过氧化钠与二氧化硫的反应。小组同学改进了右图所示的装置进行实验(已知制取SO2的反应为H2SO4+Na2SO3=Na2SO4+SO2↑+H2O)。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。试回答下列问题:
21、(13分)化学兴趣小组同学运用类比学习的思想, 探究过氧化钠与二氧化硫的反应。小组同学改进了右图所示的装置进行实验(已知制取SO2的反应为H2SO4+Na2SO3=Na2SO4+SO2↑+H2O)。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。试回答下列问题:
(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,
理由_______________________________________;
②措施:___________________________________,
理由______________________________________。
(2)某同学推断该白色固体为Na2SO3,则其所类比的化学反应是_____________________(用化学方程式表示)。 任何的推论都要经过检验,请完成对白色固体的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、试管夹;3 mol?L-1HCl、6 mol?L-1HNO3、NaOH稀溶液、蒸馏水、1 mol?L-1 BaCl2 溶液。
①
提出合理假设:
假设1:
;假设2:
;
假设3:
;
②
设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象与结论。
实验操作
预期现象与结论
步骤1:
步骤2:
…
