
2、 (20CV/a)%或0.2CV/a ( 2分)
(六)1、样品的质量、消耗标准盐酸的体积数、配制待测液的总体积、每次实验移液管移取待测液的体积 (每空1分,共4分)
2、取a克样品,配置100mL溶液,取20mL待测液,用C mol/L的标准盐酸滴定至终点,消耗盐酸VmL。试写出样品中氢氧化钠的质量分数表达式为: 。
【解析】考查中和滴定的实验操作方法,计算方法和数据记录、处理等的综合实验能力;由题干提示的溶解及中和滴定的实验步骤不难找到所缺的实验仪器。在数据处理的第2问所提供的有关数据不难找到第一问所需测定的实验数据。
【答案】(二)H++OH--=H2O (2分);
(四)玻璃棒、酸式滴定管(每空1分,共2分,不写清楚“酸式”不给分);
(五) 称量、 滴加几滴甲基橙 (每空2分,共4分); 黄、橙 (每空1分,共2分)、
1、若要测定样品中氢氧化钠的质量分数,实验中至少需要测定那些实验数据?_______________________________________。
20.(16分)有一工业烧碱(含氯化钠),现要求采用学过的定量实验的方法测定此工业烧碱中氢氧化钠的质量分数(假设各步实验中试样的损失忽略不计),请完成如下实验报告。
实验报告
(一) 实验目的:工业烧碱中氢氧化钠的质量分数测定
(二) 实验原理:(写出有关离子反应方程式):_____________________________,
(三) 实验试剂:工业烧碱、标准浓度的盐酸、甲基橙。
(四) 实验仪器:铁架台(成套)、天平、烧杯、锥形瓶、移液管、胶头滴管、100ml量筒、 ________、_______。
(五) 按实验顺序填写实验步骤: (中和滴定法)
______、溶解、移液管量取一定体积的待测液于洁净的锥形瓶中、__________、用标准盐酸滴定至终点。
当滴定至溶液由______色变为_____色,且半分钟不腿色时停止滴定。在相同条件下重复二次。
(六)数据处理及问题讨论:
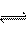 【答案】
【答案】
(1)HCl 抑制水解平衡MgCl2+H2O Mg(OH)Cl+HCl ,防止MgCl2水解(每空2分)
(2)A(2分)
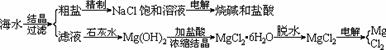
(1)由MgCl2?6H2O晶体脱水制无水MgCl2时,MgCl2?6H2O晶体在 气氛中加热脱水,该气体的作用是
(2)电解无水MgCl2所得的镁蒸气可以在下列 气体中冷却(选填代号)。
A H2 B N2 C CO2 D O2
【解析】在MgCl2.6H2O加热脱除结晶水的过程要考虑防止水解,同时电解后得到的高温Mg蒸气会和N2、CO2、O2等反应
19.(6分)海水是取之不尽的化工原料资源库,从海水中可提取各种化工原料。下图是工业上对海水的几项综合利用的示意图:
18.(8分) 反应aA(g) +bB(g) cC(g)+d D(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则
(1)平衡时A与B的转化率之比是 。
(2)若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是(a+b) (c+d ) (填“>”“=”“<”或“没关系”)。
(3)设定a=2 ,b=1,c=3,d=2,在甲、乙、丙、丁4个相同的容器中A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0。则在相同温度下达到平衡时,A的转化率最大的容器是 ,B的转化率由大到小的顺序是 (填容器序号)。
【解析】由于转化率等于转化量与起始量的比值,转化量之比与起始量之比均满足方程式的系数比,故平衡时A、B的转化率之比为1:1;同等程度的增大反应物的起始量对于等体积反应属于等效平衡,如果要使反应物的转化率都增加,则平衡需正向移动,正向为体积缩小的方向。
【答案】(1)1∶1 (2分) (2)>(2分)(3)丁 (2分) 甲>乙>丙>丁(2分)
 (3)99┱2 (2分)
(3)99┱2 (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com