
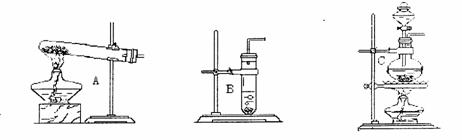
37.(7分)废物利用既可节约资源,又可以保护环境。某课外兴趣小组设计了利用废旧干电池中的锌和浓硫酸以及下图所示的装置来制取干燥、纯净的氢气,并验证气体中的杂质。
试回答下列问题:
⑴ 若实验中看到B中无水硫酸铜变蓝色,这说明生产的气体中有杂质__________(填化学式)。除此之外,该气体还可能含有的杂质气体是______________(填名称),为了检验该杂质,可将E装置连接到上述装置中__________(填序号)之间,气体从__________(“a”或“b”)
进入装置E,E中所放试剂为__________,可观察到的现象为____________________________
______________________。
⑵ 装置D的作用是___________________________________________。
36.(2分)小强设计了一个有趣的实验(如右图所示),经过很长一段时间后,他观察到小试管内有晶体析出。
⑴、下面是小强对这种现象解释的部分内容,请你帮他把其余的解释内容续写完整:浓硫酸具有吸水性,
。
⑵、若实验前后温度不变,则实验后的硝酸钾溶液的溶质质量分数 (填“大于”、“等于”或“小于”)原饱和硝酸钾溶液的溶质质量分数。
根据你的猜测,你将设计怎样的实验来验证猜测(写出实验操作及预期观察到的现象)
实验操作:
观察到的现象:
35.(5分)为验证铝比铁活泼,小雨将大小相同的铝片和铁片投入到两个盛等体积稀硫酸的烧杯中。
⑴、实验中,小雨发现铁与稀硫酸反应较剧烈,而铝片表面却无气泡冒出,小雨向老师请教,老师建议小雨将铝片先用稀NaOH溶液处理(除去铝表面致密的氧化膜),再进行实验。小雨按照老师的建议做,果然观察到预期的现象。你认为小雨将观察到的现象是:
⑵、小雨用NaOH溶液处理铝片时,注意到一个“异常”现象:将铝片投入稀NaOH溶液中,先无明显现象,一段时间后,表面出现气泡,而且越来越多。老师告诉小雨这是由于铝和氢氧化钠溶液反应的结果,并建议探究气体的成分。
假如你是小雨,根据质量守恒定律,你认为该气体成分可能是 。
为验证你的猜测,先要制取该气体。如果有如图示装置供你选择,你将选用
34.(6分)已知在溶液中氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠。现实验室中有一包白色粉末,可能是碳酸钠,也可能是氧化钙或氢氧化钙。为确定其组成,某同学设计了以下实验方案进行探究,请你按要求帮助完成探究活动。
⑴、提出假设:假设① 白色粉末是碳酸钠
假设② 白色粉末是氧化钙
假设③ 白色粉末是氢氧化钙
⑵、设计实验,通过实验分析进行判断并填空:
假设
设计的相关实验操作
实验中观察到的现象
假设是否成立
①
取一定量粉末加入稀盐酸
没有气体产生
_______________
②
取一定量粉末溶于水
溶液浑浊且温度升高
_______________
③
取一定量粉末溶于水,静置后取上层清液再通入二氧化碳
没有沉淀产生
_______________
⑶、实验后思考:假定这包白色粉末是混有少量氧化钙的碳酸钠粉末,将混合物溶于水可观
察到的现象是___________________________________________________;若将反应后的混合物
进行固液分离,分离的方法是_____________;再将分离后的溶液蒸干,得到的固体物质是
_________________(填化学式)。
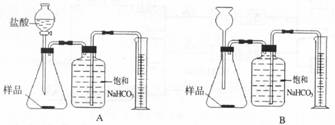
⑴ 在A和B 两套装置中,哪一套装置更合理________(选填“A”或“B”)。
⑵ 准确读取量筒内液体体积的方法是_______________________________。
⑶ 锥形瓶中原有的空气对实验结果是否有明显影响?___________(填“有”或“没有”)。
⑷ 若实验中用的盐酸是浓盐酸,则测得的样品中碳酸钠的含量与实际值相比会__________(填“偏大”或“偏小”或“不变”)。
⑸ 在实验过程中,对取用样品的量的多少有一定要求,为什么?
________________________________________________________________________。
33.(7分)我国青海湖地区素有“夏天晒盐,冬天捞碱”之说,其中捞出的碱主要是碳酸钠和少量氯化钠的混合物。小王同学以捞出的碱作为样品,并用以下一套装置对样品进行分析,根据量筒中收集到的液体的体积(相当于二氧化碳的体积)来计算样品中碳酸钠的含量。
(已知:HCl+NaHCO3===NaCl+CO2↑+H2O;CO2在饱和NaHCO3溶液中溶解度很小)
32.(3分)某校化学兴趣小组的同学探究可燃物质燃烧的条件,探究如下:
⑴ 取一支大试管,往里加2 mL30%的过氧化氢溶液;
⑵ 用镊子取一块白磷投入到试管中,可看到白磷并不燃烧;
⑶ 往试管里滴加5滴一定溶质质量分数的碘化钾溶液,不一会儿,可观察到白磷先熔化,继而燃烧起来,发出火光,并伴有白烟生成。
(提示:过氧化氢(H2O)易溶于水,在催化作用下,分解生成氧气和一种常见液体,同时放出大量的热量)试回答:
⑴ 碘化钾的作用是 ;
⑵ 写出过氧化氢分解的化学方程式 ;
⑶ 通过该实验的探究,你总结出可燃物燃烧的条件为 。
31.(4分)在下列横线上填写合适的物质:
⑴ 可用于制作电极和铅笔芯的是 。
⑵“西气东输”的天然气的主要成分是 。
⑶ 用工业酒精兑制的假酒中含有的有毒物质是 。
⑷ 广泛用于航空航天航海等领域,被称为21世纪重要金属材料的是 。
30. 如右下图所示装置进行实验(图中铁架台等仪器均已略去)。在I中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊。符合以上实验现象的I和Ⅱ中应加入的试剂是
A
B
C
D
I
CaCO3、稀HCl
Na2CO3、稀H2SO4
Zn、稀H2SO4
Cu、稀H2SO4
Ⅱ
KNO3
NaCl
BaCl2
Ba(OH)2
第二卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com