
26、(6分)雷利是英国物理学家,他曾用下列两种方法测定氮气的密度。
25、(7分)将适量黄色的草酸亚铁(FeC2O4?2H2O)粉末加入试管,在酒精灯上边加热边摇动,发生剧烈反应,产生的气体可使燃着的木条熄灭,生成黑色的粉末。反应将结束时,用橡皮塞塞好试管,稍冷后,打开塞子将所得的黑色粉末撒在石棉网上,便会立即自燃起来。试回答下列问题:
⑴黑色粉末是什么物质?为什么在空气中自燃? ;
⑵反应将结束时,用橡皮塞塞好试管有何作用? ;
⑶化学反应的快慢与反应物的表面积有何关系? ;
⑷写出草酸亚铁受热分解的化学方程式: 。
24、(5分)某生活污水有一股臭味,主要含有碎菜叶、碎塑料薄膜、泥沙、氯化钠和碳酸钠等物质。现欲将其经去渣、除臭处理后用于清洗厕所的用水。问:
⑴采取何种操作可除去其中的固体物质 ;
⑵用什么物质可除去污水的臭味 ;
⑶把生活污水进行处理再利用的目的是什么 ;
⑷怎样检验经⑴和⑵处理后的水中是否还存在氯离子 。
23.(4分)测定人体血液循环量的一种方法是:吸取6.0mL含放射性元素131I-人血清白蛋白溶液,每1.0mL含放射性元素碘2.0×10-6Ci(居里,一种放射性强度的单位),快速注入静脉中,10min时抽取1.0mL静脉血液,测定其中含放射性元素碘为0.0030×10-6Gi(10min内碘的放射性的强度改变可忽略不计)。人的血液循环量为 L。
又知碘是甲状腺素的主要成分,健康成人每天适宜摄人量为100μg~200μg(1μg为1×10-6g)。为使上述测定结果可靠,从测定人体血液循环量24h前,连续5d服用碘化钠(不含放射性碘)50mg/(5mL?d),原因是 。
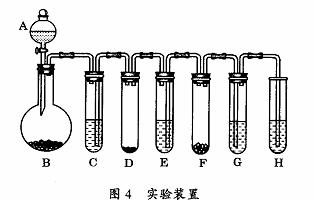
⑴实验开始前必须进行的操作是 ;
⑵反应开始后,若G中出现红色,H中有白色沉淀生成,判断E、F中的物质可能分别是:
、 ;
⑶按基本反应类型写出该实验中有关反应的化学方程式(装置用字母表示):
化合反应 ,发生在装置 中;
分解反应 ,发生在装置 中;
置换反应 ,发生在装置 中;
复分解反应 ,发生在装置 中。
22、(11分)“化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生(整个反应只需要第一个反应发生,就好像多米诺骨牌游戏一样)。以下就是一个“化学多米诺实验”,已知H2O2在MnO2的催化作用下可分解产生O2和H2O。如图所示的A-H各装置中分别盛放的物质为:A、稀硫酸;B、锌粒;C、3%H2O2溶液;D、MnO2;E、某溶液;F、某块状固体;G、滴有紫色石蕊的蒸馏水;H、足量澄清石灰水。请回答以下问题:
21、(4分)新型材料纳米级Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。实验室采用气相还原法制备纳米Fe,方法是:将固体粉料FeCl2?nH2O脱水、真空干燥,然后在高温条件下通人高纯氮气(作保护气)和氢气(作还原剂)的混合气体,生成纳米-Fe。请回答以下问题:⑴写出生成纳米-Fe的化学方程式 ;⑵反应中保护气的作用是 。
20、(3分)实验室用锌粒和稀硫酸反应制取氢气,并经过净化、干燥后,还原氧化铜来测定铜的相对原子质量。根据所得到的铜粉的质量,可求得参加反应的氢气的质量,进而计算出应消耗的锌粒和稀硫酸的质量。但实际耗用的锌粒(不含杂质)和稀硫酸的质量都远远超过计算值。试从实验过程看,原因是 。
19、(5分)实验室现有五瓶失去标签的无色溶液,根据实验室的记录,只知它们分别是KCl、K2SO4、K2CO3、AgNO3、BaCl2中的一种,为确定它们的成分,某学生将它们依次编为A、B、C、D、E,并设计了一组实验。实验记录如下:
⑴将A和B混合,产生一种既不溶于盐酸也不溶于稀硝酸的沉淀;
⑵将C和D混合,产生一种既不溶于盐酸也不溶于稀硝酸的沉淀;
⑶将A和E混合,产生的沉淀既溶于盐酸也溶于稀硝酸;
⑷将D和E混合,产生的沉淀仅在稀硝酸中消失;
⑸将B和C混合,没有沉淀生成。
由以上实验确定:A是 ,B是 ,C是 ,D是 ,E是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com