
(2)为增加驾乘人员的安全,驾驶室中设计了安全气囊(由碰撞传感器、气体发生器和气囊组成)。当行驶的汽车受到强烈震动时,传感器发出信号,气囊中的叠氮化钠(NaN3)发生分解,迅速产生氮气和固体金属钠,气囊的体积迅速膨胀,以达到保护驾乘人员安全的目的。试计算,在通常状况下,要产生60L氮气,需要分解多少克叠氮化钠?(已知:在通常状况下,氮气的密度约为1.25g/L)
46.(7分)汽车工业的迅速发展,给人们的生活带来了很大的方便。同时,汽车的安全性和汽车尾气的排放成为人们关注的问题,根据以下内容回答:
(1)研究证明,汽车尾气系统中,可以安装催化转化器,将尾气中的CO、NO在催化剂的作用下,转化成CO2和N2,以减少尾气对大气的污染。请写出上述转化的化学方程式 ,试计算NO中氮、氧两种元素的质量比 ;NO中氮元素的质量分数为 。

(1)根据乙的实验装置图分析,浓硫酸的作用是 ,碱石灰的作用是 。小明认为按照乙的方案进行测定,会导致不可避免的误差,例如:装置内空气中的CO2没有排出;反应产生的CO2未被完全吸收等。该设计中还有一个因素也会导致不可避免的误差,你认为是下列因素中的(填序号) 。
①装置的气密性不好 ②加入的稀硫酸量不足 ③干燥管与空气直接相通
(2)经测定知,该工业烧碱中氢氧化钠的质量分数为80%,某养殖户需配制2000g 2%的氢氧化钠溶液对禽舍进行杀菌消毒,需要这种工业烧碱 g。
45.(8分)“禽流感”是一种H5N1病毒引起的传染病,从禽类发病到人类染病引起了全世界的关注。预防这类病毒的方法是消毒,常见的碱类物质、甲醛等都有较好的杀死病毒的作用。其中NaOH溶液因消毒效果好且廉价易得被广泛使用,从而使工业烧碱用量增加。但工业烧碱中含有杂质碳酸钠,为了测定氢氧化钠的质量分数,某工厂甲、乙两实验员分别设计了实验方案:
Ⅰ 甲的方案是:准确称量一定质量的烧碱样品于烧杯中加蒸馏水溶解,再加入过量氯化钡溶液至沉淀完全,过滤、洗涤、烘干、称量。
(1)甲实验员洗涤沉淀的具体操作是:向沉淀中加入蒸馏水,然后过滤,重复2~3次 。确认沉淀已洗涤干净的依据是
。
(2)氯化钡溶液和氯化钙溶液都能与该样品溶液反应生成沉淀,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是
。
Ⅱ 乙的方案如下图所示:
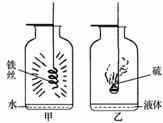
右图是同学们在探究氧气性质实验中改进的实验装置图,你认为乙装置中加入的液体是 ;简要回答甲、乙两个集气瓶中液体的作用
。
六、本题包括 2个小题 共15分
③ Cl2+K2MnO4 2KCl+MnO2+B↑
2KCl+MnO2+B↑
请写出A、B的化学式:A B 。通过以上实例,谈谈你对二氧化锰作催化剂的认识 。
① 2KClO3+2MnO2 2A+Cl2↑+B↑ ② 2A
2A+Cl2↑+B↑ ② 2A K2MnO4+MnO2+B↑
K2MnO4+MnO2+B↑
(答两条)。39.( 6分)探究是一种重要的学习方式,是充分理解学科本质的基本途径。在加热氯酸钾和二氧化锰制取氧气的过程中,鉴于制得的氧气中有氯气的气味,化学兴趣小组的同学通过查阅资料,认为反应过程如下:
38.(6分)以下是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:
试管编号
加入液体
加入物质
现象
1
10 mL水
少量食盐
不溶
2
10 mL乙醇
少量食盐
溶解
3
10 mL水
几小粒碘
不溶
4
10 mL乙醇
几小粒碘
溶解
(1)在同一条件下,物质的溶解能力与 和 有关。
(2)除(1)中的因素外,你认为固体物质的溶解能力还与外界条件 有关。
如果外界条件和溶剂的种类确定,要比较硝酸钾和氯化钠的溶解能力,实验中需要控制的因素是 。
(3)根据甲、乙两种固体物质的溶解度曲线,你能获得的信息是
37.(5分)氨气(化学式NH3)是一种具有刺激性气味的气体,极易溶于水,其水溶液易挥发、呈碱性。如果实验室要收集一瓶氨气,应采取的收集方法是 ,用湿润的pH试纸伸入集气瓶中,试纸呈 色。我国著名的化学家 先生发明的制碱原理为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,用 的方法可以把NaHCO3晶体从混合物中分离出来,在制取NaHCO3时,先向饱和的NaCl溶液中通入较多的NH3,再通入足量的CO2的目的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com