
某同学为了提纯某一苯甲酸样品(其中含泥沙等难溶于水的杂质),进行了如下实验:
⑴取样品约
⑵将烧杯放在石棉网上加热,将样品充分溶解后,在加入少量蒸馏水,然后趁热过滤。趁热过滤的目的是 。
⑶将所得滤液 ,使苯甲酸以晶体形式析出,然后过滤得到较纯净的苯甲酸晶体。
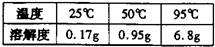
2.(3分)苯甲酸是一种食品防腐剂,它是一种片状晶体,在水中的溶解度如下表:
1.(3分)我国制碱工业的先驱侯德榜发明了侯氏制碱法,为我国制碱工业的发展做出了极大的贡献。纯碱(化学式为Na2CO3)是常见的工业用碱,也是许多化工产品的生产原料,在生活和生产中得到广泛应用。
⑴纯碱不是碱,在化学物质分类中属于________类物质;
⑵石灰石、大理石的主要成分是碳酸钙,在组成上与纯碱具有相同的组成部分,因而,它们都能与盐酸反应产生(填具体物质)__________气体;
⑶纯碱溶液与石灰水反应可制得少量NaOH溶液,在反应基本类型中,该反应属于_____________反应。
(1)该纯碱样品的纯度(计算结果精确到0.1%)。
(2)所得溶液中溶质的质量分数。
33.(7分)我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献。工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质。现称取只含氯化钠杂质的纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g。试求:
32.(3分)“禽流感”是一种由病毒引起的传染病,从禽类发病到人类染病引起了全世界的关注。预防这类病毒的方法是消毒,其中NaOH溶液因消毒效果好且廉价易得被广泛使用。某工业烧碱中氢氧化钠的质量分数为80%,一养殖户需配制2000g2%的氢氧化钠溶液对禽舍进行杀菌消毒,需这种工业烧碱_______g。
(3)假设每步都反应完全,生成的二氧化碳全部被吸收,不考虑空气中二氧化碳的影响。较准确地计算“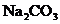 含量≥95%”是否真实,该实验除称取样品质量外,还要用天平量得到的实验数据是 _________。
含量≥95%”是否真实,该实验除称取样品质量外,还要用天平量得到的实验数据是 _________。
(4)若乙装置中加入浓盐酸(有挥发性),对测量结果会产生影响。原因是浓盐酸挥发出的氯化氢气体__________。
(5)若实验装置连接正确,实验过程中看到丙装置出现的气泡比丁少得多,一种可能的原_____________。
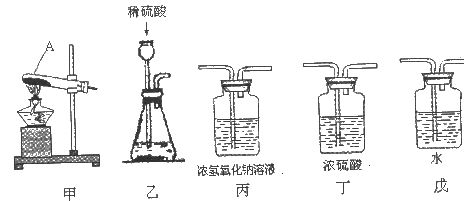
(1)写出上图仪器A的一种常见用途___________。
(2)你选择的实验装置从左到右组装排列为(填编号)___________。请说出你选择或排列装置的一点理由_________。
31.(8分)纯碱(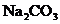 )产品中常含有少量氯化钠。某厂生产的纯碱包装袋上标有“
)产品中常含有少量氯化钠。某厂生产的纯碱包装袋上标有“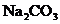 含量≥95%”字样。为判断该产品中
含量≥95%”字样。为判断该产品中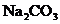 的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图。其中,丙装置中装足量浓氢氧化钠溶液,丁装置中装浓硫酸,戊装置中装水。(提示:浓硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解。)
的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图。其中,丙装置中装足量浓氢氧化钠溶液,丁装置中装浓硫酸,戊装置中装水。(提示:浓硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解。)
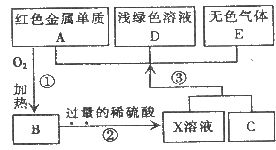
(1)反应①的基本反应类型是__________;其反应的化学方程式__________;
(2)C的化学式为 __________;
(3)写出过程③中生成金属单质A的化学反应方程式 ____________________
(4)右图转化中产生无色气体E的原因是_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com