
31.【研究课题】:探究热水壶底部水垢的主要成分
【查阅资料】:该小组同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子趋于生成溶解度更小的物质――水垢(主要成分为碳酸盐、碱的混合物)。同时,他们还查阅到下列有关物质的溶解性:
物质
Ca(HCO3)2
Mg(HCO3)2
Ca(OH)2
Mg(OH)2
CaCO3
MgCO3
溶解性
可溶
可溶
微溶
不溶
不溶
微溶
【提出猜想】:水垢的主要成分一定含有Mg(OH)2和 ,可能含有Ca(OH)2和 。
【设计方案】:
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入 ,没有白色沉淀,说明水垢中无Ca(OH)2;
(2)乙同学设计下列实验装置,进一步确定水垢中含有碳酸盐的成分,步骤如下:
①按图组装仪器,将
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变。
30.某同学将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液,并对滤液的组成进行探究。
(1)锌和硝酸银溶液反应的化学方程式 。
(2)同学们对滤液中所含的溶质做出多种猜想,其中有两种猜想可能成立,这两种猜想是:
①溶质为 ;②溶质为 。
方案
实验操作
实验现象
结 论
方案一
猜想 成立
方案二
猜想 成立
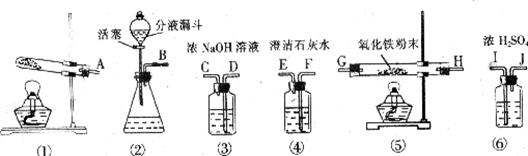
(1)用甲酸滴入浓硫酸的方法制取CO,应选 (填序号)装置;如果要除去CO气体中混有少量的甲酸,最好选择上图中 (填序号)进行洗气。
(2)用上述方法制取的CO还原氧化铁,并检验气体产物,则各仪器的接口连接顺序为 ___________________________________________(填字母)。
(3)在对氧化铁粉末加热前,为安全起见,应进行的一项重要操作是 。
(4)从开始加热到实验结束,氧化铁粉末的颜色变化为 ,反应方程式为 。
(5)上述实验的尾气不能直接排放到空气中,请你说出一种处理尾气的方法: 。
29.甲酸(HCOOH)通常是一种无色易挥发的液体,它在浓硫酸作用下易分解,反应方程式为:HCOOH CO↑+H2O。某课外活动小组的同学欲用该反应来制取CO,并还原红棕色的氧化铁粉末。现有下列仪器或装置供选择:
CO↑+H2O。某课外活动小组的同学欲用该反应来制取CO,并还原红棕色的氧化铁粉末。现有下列仪器或装置供选择:
28.小明同学在使用“除垢净”去除热水壶中的水垢时,发现有大量的气泡产生,联想水垢的主要成分是碳酸钙。小明猜想“除垢净”的成分中可能有酸。
①为证实自己的猜想,小明从家中又找来两类不同的物质进行实验:
实验一: ;
实验二: 。
经实验,小明得出“除垢净”的有效成分中一定有酸的结论。
②小明想试制一瓶“除垢净”,你认为HCl、H2SO4两种酸中的 更合适,理由是 。
③结合上面对“除垢净”的了解,在使用“除垢净”时应注意 。
五、实验与探究(本题包括4个小题,共30分)
27.小明、小鹏和小芳三位同学在一起探究蜡烛燃烧,他们将短玻璃导管插入焰心,发现另一端也可以点燃。
(1)【提出问题】导管里一定有可燃性气体,气体成分可能会是什么呢?
(2)【猜想】小明认为:可能是蜡烛不完全燃烧时产生的CO。
小鹏认为:可能是蜡烛受热后产生的蒸气。
小芳认为:可能上述两种情况都有。
(3)【设计实验方案】请你帮助他们设计一个简单的实验方案,来判断哪一种分析是正确的_____________________________________________________________________________。
(4)【现象与结论】如果小明的猜想正确,现象应是 。
如果小鹏的猜想正确,现象应是 。
如果小芳的猜想正确,现象应是 。
(5)如果用CnH2n+2表示蜡烛的主要成分,其燃烧的化学方程式为: 。
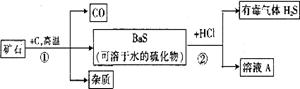
(1)步骤①中,哪些元素的化合价升高,哪些元素的化合价降低? ;
(2)步骤②中溶液A中溶质的化学式: ;
(3)写出利用溶液A中的溶质为主要原料制取BaSO4的化学方程式: ;
(4)步骤②产生有毒气体H2S,应加以改进,为使实验既不产生H2S又能获得纯净BaSO4,请你提出改进意见 ;有关反应的化学方程式是 。
26.自然界的矿物中有一种重晶石矿,它的主要成分是BaSO4,它不溶于任何酸、碱和水,纯净的硫酸钡可供医疗等方面应用。某同学用重晶石和焦炭为原料,制取纯净硫酸钡,部分流程如下(设矿物中杂质不与焦炭反应,也不溶于水):
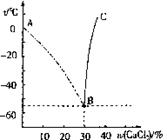
(1)氯化钙溶液可用作冷冻剂,当无水氯化钙与水混合的质量比为 时(填写最简整数比),冷却效果最好。
(2)指出两条曲线分别表示的具体含义:
曲线AB: ;
曲线BC: 。
(3)将
A.此时溶液处于不饱和状态
B.溶液中析出了氯化钙晶体
C.溶液中已经有冰析出
D.此时冰、氯化钙晶体和氯化钙饱和溶液共存
E.此时氯化钙晶体和氯化钙饱和溶液共存
25.将一种盐溶于水,会使水的冰点(凝固点)降低,冰点降低多少与盐在溶液中的质量分数有关。如果将此盐溶液降温。则在零度以下某温度会析出冰。但当盐在溶液中的质量分数比较大时,在将溶液冷却的过程中先析出的固体不是冰而是盐的晶体。如图所示,横坐标为氯化钙溶液中溶质的质量分数,纵坐标为温度,试填空或简答:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com