
33.某工厂以流量
32.(8分)已知:碳酸钠溶液的pH>7。甲、乙、丙、丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,可是过了一会儿红色就消失了。这是什么原因呢?他们依据所学的化学知识,分别对这种意外现象的成因作了如下猜想:
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液的浓度大小有关。
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是: ;
(2)丙同学认为乙同学的猜想也不正确,他的理由是: ;
(3)四位同学讨论后认为要验证丙同学的猜想,还需作如下实验,你知道该实验目的吗?
实验步骤
设计这一步骤的目的
①将配制的氢氧化钠溶液加热
②在加热后的溶液中滴入酚酞,并在上方滴一些植物油
通过以上实验,四位同学观察列的现象是:溶液先变成红色,过了一会儿红色仍消失。
(4)(4分)若丁同学的猜想正确,大家能设计实验证明吗?
实验方法
可能观察到的现象和结论
六、计算题(本题包括一个小题,6分)

(1)选择任意一种实验装置,简述出现的实验现象,解释产生该实验现象的原因:选择的实验装置是 ,实验现象为 ;产生该实验现象的原因是: ;
(2)某同学质疑上述实验设计,该同学质疑的依据是 ;
(3)(2分)在原实验基础上,请你设计实验证明CO2和NaOH肯定发生了化学反应 。
31.(6分)为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计出了下列4种实验装置,请回答下列问题:
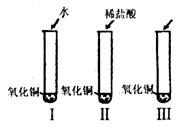
(1)你提出的假设是 ;
(2)通过实验Ⅰ可证明 ;
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和实验Ⅲ,在实验Ⅲ中应加入 ;
(4)探究结果为 ;
(5)请写出氧化铜与稀盐酸反应的化学方程式: 。
30.(5分)氧化铜是一种黑色固体,可溶于稀盐酸。某同学想知道是稀盐酸中的哪种粒子(H+、Cl-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动。
29.(7分)中和反应在日常生活和工农业生产中有广泛应用。
(1)农业上可用来降低土壤的酸性,改良土壤结构的物质是 。
(2)医疗上可用含氢氧化镁的药物来中和过多的胃酸(视为盐酸),有关反应的化学方程式为 。
(3)(4分)如何检验某硫酸厂排出的废水是否具有酸性?请设计出两种实验方案(写出简要的实验步骤、现象及结论)。
方案一: ;
方案二: 。
(4)取某硫酸厂排出的一定体积的废水与一定量的氢氧化钠溶液混合后,溶液恰好呈中性。若改用与该氢氧化钠溶液的质量和溶质质量分数均相同的氢氧化钾溶液与上述一定体积的废水混合,则所得溶液的pH 7(填“>”、“<”或“=”)。
五、实验题(本题包括3个小题,共19分)
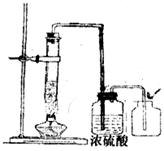
①由第一组同学的实验可得出:影响H2O2分解产生O2的量的多少及分解快慢的因素之一是 ;
②第二组同学的实验验证了实验前同学们猜想的正确性,其中浓硫酸的作用是 ;
(3)另有同学在5%的H2O2溶液中加入少量二氧化锰固体粉末,常温下,用带火星木条检验,木条复燃;此实验中二氧化锰所起的作用可能是 ,有关化学方程式为 。
28.(6分)某学校化学兴趣小组同学在学习了制取氧气这节内容后,发现在实验室里用5%H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃。同学们经过认真观察,猜想其可能原因是 或 。为了验证此猜想是否正确,兴趣小组的同学经过热烈讨论,制定了实验方案并进行了实验。
(1)第一组同学采取增大H2O2溶液浓度的方法,用10%的H2O2溶液加热,结果一段时间后,用带火星的木条检验,木条复燃;
(2)第二组同学从实验装置上进行了改进,效果很好(见下图)。在实验基础上,同学们经过交流讨论,得出了一些结论:
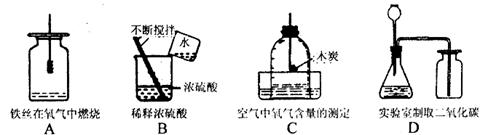
(1)A实验中未观察到明显现象的原因 ;
(2)B实验可能造成的后果 ;
(3)C实验测定结果偏低的原因 ;
(4)指出D实验中的错误 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com