
求:(1)稀盐酸的质量分数及与稀盐酸反应的Fe的质量
(2)与CuSO4反应的Fe的质量
(2)将9.
(1)取8.
25.
求:(1)需要此NaOH溶液多少克?
(2)反应后所得溶液中溶质的质量分数
附加题(本题包括1小题,共10分,计入总分,但整卷总分不超过100分)
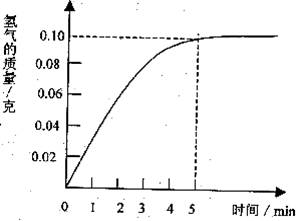
某化学兴趣小组在做Fe和CuS04溶液反应时,发现生成Cu的同时有气泡产生,为了进一步研究做了如下实验:

(3)提出问题:铜器表面附着的绿色固体物质是由哪些元素组成的?猜想:查阅相关资料后,猜想绿色固体物质可能是铜绿。
设计与实验:
①对试管内的绿色固体加热,至完全分解。观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。实验结论:绿色固体物质中含有 、 、 、 等元素。(提示:装置内的空气因素忽略不计)
表达与交流:
①图中标有a.b的仪器名称是:a b
②上述③中发生反应的化学方程式为
③反应完成后,如果先移去酒精灯,可能出现的现象是:
④如果将B、C两装置对调,行吗?为什么?
五、计算题(本题包括1小题,共6分)。
24.2003年6月,西安北郊古墓中出土二青铜锤(一种酒具),表面附有绿色固体物质,打开盖子酒香扑鼻,内盛有
(1)如果让你对出土的“西汉美酒”进行探究,你想探究的一个问题是:
(2)上述报道引发了某校初三化学兴趣小组同学的关注,他们收集家中铜器表面的绿色固体,进行探究。
23.硫酸亚铁是一种重要的化工原料,用途十分广泛,如医疗上可用于治疗缺铁性贫血;农业上可施用于缺铁性土壤等。某校化学兴趣小组,利用工业废铁屑为原料设计如下两种制备硫酸亚铁的方案:
①Fe + H2S04==FeS04 + H2↑
②2FeO + 4H2S04(浓)==Fe2(S04)3+S02↑十+4H20 Fe + Fe2(S04)3==3FeS04
(1)两种方案都有一定的理论依据,他们选用了方案①,那么不用方案②的理由是
(2)实验过程中,如何判断方案①的反应已经停止
(3)利用工业废铁屑为原料制备FeSO4的现实意义是:
(4)工业废铁屑常沾有油污,去除油污的方法是
(5)他们在配制所需的稀硫酸时使用了自来水,小明提出自来水中含有少量的Cl-会影响到制出的FeS04的纯度,请你设计实验证明已配制的稀硫酸中混有Cl-
实验步骤
实验现象
结论
22.取两块大小相同的干冰,在干冰中央挖一个小穴,撒入一些镁粉,用红热的铁棒把镁点燃,将另一块干冰盖上,你会看到镁粉在干冰内继续燃烧,发出耀眼的白光,像冰灯一样。已知该反应的生成物是氧化镁和碳。该实验证明干冰具有 的性质(答一条即可);为验证上述反应所得固体中无剩余的镁,可向该固体中加入试剂的名称为 ,反应的现象是
21.北京
(1)造成酸雨污染呈加重趋势的原因是(写一种)
(2)每个家庭都离不开燃料。你家使用的燃料是 ,你家在使用燃料时,使燃料充分燃烧的方法是 如果燃烧不充分可能产生的后果是 。
(3)山西污染指数中居首位的是可吸入颗粒物,这与所处地区自然资源与工业生产直接相关,你认为造成空气中可吸入颗粒物增多的原因是(写一种)
(4)取海河水系某支流河水分析,其主要污染物有较多悬浮物,河水呈碱性,水中含较多 CO32-和有机物质(淀粉、蛋白质、洗涤剂等),还有大量病原体(如细菌、寄生虫等)
①用pH试纸测定河水酸碱度的方法是
②要除去水中的细小颗粒,可在水中加入 (填物质名称)作净水剂,然后静置处理。
③要除去水体中较多的CO32,并使水体呈中性,可加入的物质是(写一种) 。
④为有效消除水体中的病原体,可选用下列物质中的 。
A.二氧化碳 B.漂白粉 C.氧气 D.石子和细沙
20.将20ml水倒入装有20ml95%的酒精的烧杯中,混合均匀后体积为Vml,再将一块手帕浸入该溶液中,用镊子夹起手帕,点燃手帕上的酒精,当手帕上的火焰即将熄灭时,将手帕晃动几下,火熄灭,手帕完好无损。
(1)混合后的溶液中溶质是 。
(2)混合后的体积VmL 40ml。(填“>”“<”或“一”),原因是
(3)手帕完好无损的原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com