
⑶乙方案中,需用一定质量的19.6%的稀硫酸。现有一瓶98%的浓硫酸(密度为
Ⅱ 操作步骤:称取13.25g纯碱样品,加入过量的澄清石灰水,充分搅拌。过滤、洗涤、干燥,得到白色沉淀10.00g。
Ⅲ 数据处理:请根据上述实验数据,计算该样品中碳酸钠的质量分数。
计算过程:
Ⅳ 实验结论: 。
乙方案
Ⅰ 设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为bg),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
Ⅱ 实验结论:
⑴当a、b的质量关系满足 (填写含a、b字母的表达式,下同)时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100%。
⑵当a、b的质量关系满足 时,纯碱样品是由碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是 。
【实验评价】
误差分析:⑴甲方案中,白色沉淀的质量在过滤、干燥等操作过程中会有损耗,造成计算结果与实际值相比偏小。⑵乙方案中,有部分生成的二氧化碳因溶解于水而没有全部逸出,造成计算结果与实际值相比 (填写“偏大”、“偏小”或“不变”)。
【交流反思】
⑴实验过程中,需用玻璃棒不断搅拌。该操作的目的是 。
⑵甲方案实验操作中,对沉淀洗涤的目的是 。
21.(10分)碳酸钠,化学式Na2CO3 ,俗称纯碱。“纯碱中常常会混有少量的氯化钠”。某研究性学习小组以一包纯碱(若有杂质,只考虑为氯化钠)为研究对象,探究该纯碱样品中碳酸钠的含量。请你参与他们的活动。
【小组讨论】
观点Ⅰ:纯碱样品中只含有碳酸钠
观点Ⅱ:纯碱样品是由碳酸钠和少量氯化钠组成的混合物
【实验设计】
甲方案
Ⅰ 设计思路:根据样品与石灰水反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
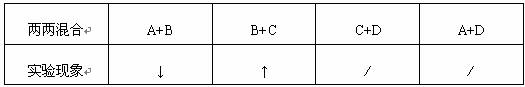
则小明可以得到的结果为:A是 ,D是 。
五、科学探究(本大题包括1小题,共10分)
20.(5分)实验室有A、B、C、D四瓶无色溶液,分别是稀硫酸(H2SO4 )、饱和石灰水[Ca(OH)2 ]、氢氧化钠溶液(NaOH)、硫酸钠溶液(Na2CO3)四种物质中的一种。可供使用的实验用品有:pH试纸、稀盐酸、玻璃棒、试管、玻璃管。
⑴请利用提供的实验用品,鉴别出四种物质并完成实验报告:
实验步骤
实验现象
实验结论
①取样,分别用玻璃棒蘸取四种溶液,滴到pH试纸上,与标准比色卡对照
B溶液的pH<7,
其余溶液的pH>7
B是 溶液
②取三支试管,各取少量的A、C、D溶液,分别滴加稀盐酸
A是碳酸钠溶液
③取两支试管,各取少量的C、D溶液,用玻璃管分别吹入CO2
C是饱和石灰水
⑵小明认为:不用任何试剂,只要几支试管即可完成鉴别实验。他将四瓶试剂重新编号,并将四种溶液两两混合,部分实验结果记录如下。
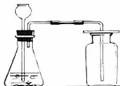
⑶小明拟选用仪器C、D、F、G、H再设计一套制取氧气的装置,他还需选用的仪器是 (填写仪器序号),该装置中所用的药品是 (填写药品名称)。
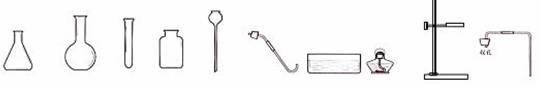
⑴上图A、B、C、D中能直接加热的仪器是 (填写仪器名称)。
⑵下图为小明组装的CO2制取装置,装药品前首先进行的操作是 。他认为该装置也可以用于制取氧气,其制取氧气的化学方程式为 。
②粗盐提纯实验中,先称取
⑵我市有蕴藏量丰富的石油天然气,有丰富的沿海风力资源。风电场的建成投产,有助于减少CO2的排放。
①天然气是不可再生能源,其主要成分为 。
②CO2 的排放是造成“温室效应”的原因之一。下列说法正确的有 。
(填写选项序号)。
A.植树造林,严禁乱砍滥伐树木
B.节约能源,减少煤、石油等化石燃料的燃烧
C.严禁钢材、铝材、铁合金、氧化铝等高耗能产业的生产
D.开发新技术,利用太阳能、核能、风能、地热能等新能源
⑶在沿海经济大开发的进程中,要坚持开发与环保并重。
①某化工厂有甲、乙两个车间,排出的废水澄清透明,分别含有三种不同的离子,共有K+、Ba2+、Cu2+、OH-、NO3-、CO32-六种离子(部分物质的溶解性见下表)。已知甲车间废水明显呈碱性,则乙车间废水中含有的阴离子是 。将甲、乙两车间的废水按适当比例混合,可以变废为宝,既能使废水中的Ba2+、Cu2+、OH-等离子转化为沉淀除去,又可以用上层清液浇灌农田。清液中的溶质主要是 (填写物质化学式)。
阴离子
阳离子
OH
NO3-
CO32-
K+
溶
溶
溶
Ba2+
溶
溶
不
Cu2+
不
溶
不
②根据上表,判断,Cu(NO3)2 和Ba(OH)2 溶液 (填写“能”或“不能”)发生复分解反应。能反应的写出化学方程式,不能反应的写出理由:
|