
铁锈的成分主要为Fe2O3?H2O,还含有少量的FeCO3。某兴趣小组设计如图装置测定锈铁钉的组成。取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少。该过程中仅考虑发生:Fe2O3?H2O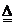 Fe2O3+H2O↑,FeCO3
Fe2O3+H2O↑,FeCO3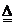 FeO+CO2↑,且不需要考虑装置中空气对本实验的影响。(碱石灰成分:CaO和NaOH固体混合物。物质的相对分子质量:Fe2O3?H2O―178,FeCO3―116)
FeO+CO2↑,且不需要考虑装置中空气对本实验的影响。(碱石灰成分:CaO和NaOH固体混合物。物质的相对分子质量:Fe2O3?H2O―178,FeCO3―116)

(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接入到装有水的烧 杯中,微热甲装置,说明气密性良好的现象是 。
(2)反应开始后,甲装置中反应现象是 ,MnO2的作用 。
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮。该实验说 明铁生锈主要与 和 有关。B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是 。
问题二:测定铁锈的组成
28.(16分)全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。下面是对铁的腐蚀条件及铁锈组成的探究。
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验。
(有关物质的相对分子质量:NaCl―58.5,AgCl―143.5)
④经精确测定AgCl沉淀质量为2.87g,则该味精中NaCl的质量分数为 。
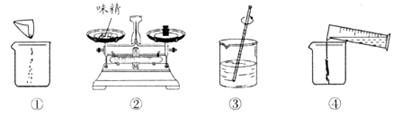
(4)为测定味精中NaCl的质量分数,进行如下实验:
①向所配制的50g溶液中加入过量的AgNO3溶液充分反应(NaCl+AgNO3=AgCl↓+NaNO3),检验沉淀是否完全的方法是:静置后,在上层清液中加入 溶液(填化学式),观察是否有沉淀生成。
②过滤后,洗涤、干燥、称量AgCl固体。洗涤的目的是洗去AgCl固体表面的可溶性杂 质,可溶性杂质中一定有 。
③在其他操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制 溶液的谷氨酸钠质量分数 (填“偏大”、“偏小”或“无影响”),所测定的味精中NaCl的质量分数 (填“偏大”、“偏小”或“无影响”)。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是 。(填字母)
A.10 mL B.50 mL C.100 mL
(3)下图是配制过程,正确的操作顺序为 → → → 。 (填序号)
27.(9分)味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl(其他成分不考虑)。请回答 下列问题:
(1)味精中至少含有 种元素(填数字)。

其中操作A的名称为 ,所需要的玻璃仪器有: 、烧杯、玻璃棒。人体必需元素有20多种,缺碘会患 。
五、(本题包括2小题,共25分)
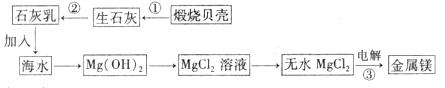
写化学反应方程式:
① ;② ;③ 。
(3)海带中含有丰富的碘,实验室从海带中提取碘的流程如图:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com