
试管和固体物质的质量
B
试管的质量
(1)实验中最多能得到铜多少克?(写出计算过程)
(2)同学们想通过测定消耗碳、氧元素的质量和生成二氧化碳的质量,以进一步分析氧化铜和炭粉反应产生的气体除CO2外是否还有其他产物.反应一段时间后停止加热,冷却到室温.
反应前、后测得的数据如下:
装置
反应前
反应后
A
37.某课外活动小组的同学将
2.8
10%、50 mL
(3)分析探究:将铁粉加入到盛盐酸的烧杯中发生反应,写出反应的化学方程式 .哪两组实验用来探究“温度越高,化学反应越快”的假设? .
(4)讨论反思:事实上,化学反应的发生,是反应物的微观粒子相互接触、碰撞的结果.请你解释“盐酸浓度越大,与铁粉反应越快”的原因 .
2.8
20%、50 mL
3
20
2.8
10%、50 mL
2
10
33.同学们都有这样的学习、生活经验:木炭在氧气中燃烧比空气中燃烧得更旺;夏天,将食品放在冰箱里不容易腐烂.说明反应物的浓度和温度对化学反应快慢(反应速率)有影响.那么,浓度和温度是如何影响化学反应速率的?
(1)提出假设:a.浓度越大,化学反应越快;b.温度越高,化学反应越快.
(2)设计方案:同学们利用铁粉和盐酸反应来探究上述问题,设计了下列3组实验.
组别
温度/℃
铁粉质量/g
盐酸的质量分数和体积
观察气泡产生的速率
l
10
根据实验现象回答:
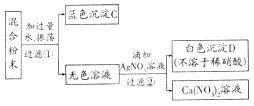
(1)写出步骤②发生反应的化学方程式 .
(2)判断化合物A为 .
30.固体化合物A由两种元素组成,化合物B是盐.为了确定它们的成分,各取适量的两种固体粉末混合均匀,按以下步骤进行实验并记录实验流程:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com