
烧杯和其中混合物的质量为107.
试通过分析计算:(1`)该实验中生成的二氧化碳的质量是多少克?
(2)石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
石灰石样品样品的质量为12.
烧杯和盐酸的质量为100.
烧杯的质量为50.
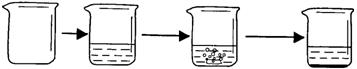
实验数据
 |
 |
 |
|||
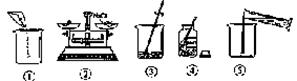
(1)配制过程中使用的四种玻璃仪器,分别是广口瓶、________、_________、量筒。请你指出图中一处错误操作,并分析该操作可能造成的后果。___________________________。
(2)图②、图③表示的操作步骤分别是________________、 。
配制时需称量氯化钠____________g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会________________(填“偏大”或“偏小”);量取水最好选择______________的量筒(填序号①10mL②50mL③100mL)。(水的密度为
实验步骤
①称取烧杯的质量
②将适量盐酸加入烧杯中并称重
③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应
④待反应完全后,称重
实验图示
24、下表是某同学探究金属活动性顺序的实验报告,请你在空白处填空。
实验步骤
实验现象
解释
(1)将锌片、铜片分别投入到盛有稀H2SO4的试管中。
反应的化学方程式为
(2)将铜片投入到盛有AgNO3溶液的试管中。
在铜片的表面覆盖了一层银白色物质,溶液呈 色
反应的化学方程式为
结论|:Zn、Cu、Ag三种金属由强到弱的活动顺序为
25、下图是小明配制
23、某班同学在实验室进行了“酸的性质”实验,使用过的试剂有:①铁屑②氧化铁③盐酸④氢氧化钠溶液⑤碳酸钠溶液。
(1)实验结束,他们将废液全部废液倒入废液缸。为了使废液能无害排放,需要用_______________测定废液的酸碱度,测定废液的pH=1,废液呈______性。
(2)以上提供的5种试剂在废液中不可能有的是___________( 填序号),你选择的理由是(用化学方程式说明)_______________ ;
___________________________; ;
。废液中的溶质最多可能有________种。

固体A
固体B
固体C
水
不溶解
白色浑浊并放出大量热
溶解吸收热量
盐酸
固体消失有气泡并放热
白色固体消失无气泡放热
固体消失无气泡
则固体A是 B是 C是 。
(2)奥运五环旗的每一个环表示一种物质,相互连接的物质间能发生反应。请从以上七种物质中选出符合要求的三种物质将其名称填入环内。
22、常温下有CaCO3、Ca(OH)2、Mg条、硝酸铵、CaO、食盐、Na2CO3七种固体物质。
(1)从中选出三种物质分别加入水和稀盐酸中,产生现象如下:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com