
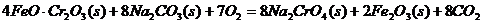 该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是
。
该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是
。
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格。完成上述过程。
序号
实验步骤
简述实验操作(不必叙述如何组装实验装置)
①
溶解
将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解。
②
③
④
⑤
过滤、干燥
得到K2Cr2O7晶体
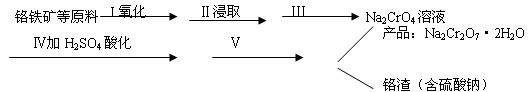
①步骤I中反应的化学方程式为:
27.(14分)红矾钠(重铬酸钠:Na2Cr2O7?2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO?Cr2O3)利用以下过程来制取。
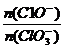 将 2(填“>”“<”或“=”);若
将 2(填“>”“<”或“=”);若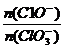 =a,则n(C1-)=
=a,则n(C1-)=
mol(用含a的代数式来表示)。
附加题:本题仅供有有兴趣的同学参考,不计入本次考试的成绩中。
试回答:
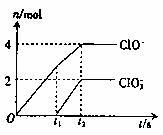
(1)t2时,Ca(C1O)2与Ca(C1O3)2的物质的量之和为 mol,该石灰乳中含有的Ca(OH)2的质量是 g。
(2)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通过氯气的速度不同,C1O-和C1O3-的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后
26.(9分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应)。生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。已知,生成C1O3-离子的反应为:
6Ca(OH)2+ 5CaC12+Ca(C1O3)2+6H2O。
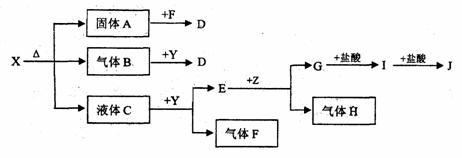
(1)写出X、E、I的化学式。X E I 。
(2)写出Y的电子式 。
(3)关于Y的说法正确的是 。
A.Y是氧化物 B.Y是过氧化物
C.Y是含有非极性键的离子化合物 D.Y是碱性氧化物
(4)写出B和Y反应的化学方程式: 。
(5)X和G的溶液能反应吗?如能反应,写出反应的离子方程式;如不能反应,请说明理由:
六题(共1小题,9分)
25.(11分)下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是固体金属单质,Y中阳离子与阴离子个数比为2:1 ,化合物X、Y、A、D、E、G的焰色反应为黄色,I是白色沉淀。
24.(14分)某研究性学习小组探究下列化学反应的特征:
(I)KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(Ⅱ)FeS+HNO3→Fe(NO3)3+Fe2(SO4)3+NO2↑+N2O4↑+NO↑+H2O
(Ⅲ)CuSO4→CuO+SO3↑+SO2↑+O2↑
(Ⅳ)CO2+KOH→KHCO3+K2CO3+H2O
⑴大多数化学反应中物质的化学计量数之比是固定的,但上述化学反应的化学计量数之比是不确定的,即物质的化学计量数有多组。根据上述实例,请用一句话归纳化学计量数有多组的化学反应的特点: 。
⑵反应(Ⅱ)中还原产物是 ,若其物质的量之比确定,该反应的化学计量数也随之确定。
⑶有人认为反应(Ⅲ)是两个反应式加合的结果,请分析它是哪两个化学反应加合而成的:______________________________________、_____________________________。
在反应(Ⅲ)中,根据电子转移守恒,物质_______和 的物质的量之比是固定的。
⑷若将16gCuSO4固体粉末按反应(Ⅲ)完全分解,最终气体产物的物质的量的取值范围是: 。
⑸若反应(Ⅳ)中KHCO3、K2CO3的化学计量数分别为a、b,则用a、b表示该反应的化学计量数的化学方程式是 。
③取②中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体
则该药剂中三种主要成分的物质的量之比为n(MgCO3):n(Mg(OH)2):n(Al(OH)3)=_________。
五题(共2小题,25分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com