
4.下列实验基本操作不正确的是 ( )
A.向试管中加块状固体药品时,先将试管横放.把药品放在管口处,再慢慢竖起试管
B.过滤时,应将玻璃棒下端轻靠在三层滤纸上
C.向试管中滴加液体时,为了防止液体滴到试管外,滴管应伸入试管内
D.用托盘天平称量固体时,把药品放左盘,砝码放右盘
3.我们的生活中离不开能源。下列做法利用了化学能的是 ( )
A.使用干电池 B.利用水力发电
C.使用太阳能热水器 D.开发温泉浴
2.
A.氮气 B.氧气 C.二氧化碳 D.水
1.日常生活中见到下列现象,其中发生了化学变化的是( )
A.冬天的早晨,玻璃窗上出现美丽的雪花
B.自行车轮胎在烈日下爆裂
C.牛奶放置时间过长结块
D.玻璃杯打碎
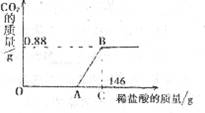
(1)关系图中OA段、AB段对应的过程中发生反应的化学方程式分别为:
________________________________,________________________________;
(2)计算出A点对应的数值及粗产品中氢氧化钠的质量。(计算结果保留两位小数)
30.(8分)某兴趣小组同学对于实验室制得的烧碱粗产品(杂质为Na2CO3和NaCl)进行了测定分析。取
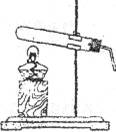
(2)用____________ (填仪器名称)把Ca(HCO3)2粉末加入试管中。加热时应先_____________________,后集中加热装有药品的部位。观察到试管口附近有小液滴产生。
【得出结论】Ca(HCO3)2受热能分解。
【反思与评价】
(1)小松认为小强的实验不能确切证明Ca(HCO3)2受热一定分解了,理由是________________________________ 。
(2)请你设计实验证明加热过程中有CO2产生。
实验过程
实验现象
实验结论
有CO2生成
(3)Ca(HCO3)2受热分解的化学方程式为________________________________。
29.(10分)一双善于发现惘题的眼睛能够带来许多意想不到的知识。
【发现问题】一一次探究活动中,小强用塑料吸管向新制的澄清石灰水吹气,在吹气的过程中发现石灰水先出现浑浊后又变澄清,他感到很意外。
于是,小强又将纯净的C()!通人新制的澄清石灰水中,观察到与上次相同的现象。
(1)小强做第二个实验的目的是________________________________。
(2)小强从老师那里得知:CO2能与CaCO2和H2O继续反应生成Ca(HCO3)2。由此,他推测出Ca(HCO3)2的一条物理性质是______________ 。小强还想了解Ca(HCO3)2的化学性质。
【提出问题】Ca(HCO3)2能否象NaHCO3一样受热分解?
【查阅资料】Ca(HCO3)2受热分解生成CaCO3、H2O和CO2。
【实验过程】
(1)安装下图所示实验装置,安装仪器时,试管口要略低于试管底,目的是________________________________________________________________。
28.(9分)有一包从海水中获得的的粗盐(杂质可能为CaCl2或MgCl2),现对它的成分进行探究,并测定粗盐中NaCl的质量分数。
探究一:这包粗盐中究竟有什么杂质?
实验步骤:取样并溶解,加入数滴NaOH溶液,无明显现象,接着再加入数滴Na2CO3溶液,有白色沉淀生成,证明粗盐中的杂质是________________。
探究二:这包粗盐中NaCl的质量分数是多少?
实验步骤:①称取一定质量的样品;②将样品加水溶解制成粗盐溶液;③向粗盐溶液中加入过量的Na2CO3溶液,过滤;④将沉淀充分洗涤干净后小心烘干,得到纯净固体A。称量沉淀质量,由此进一步计算出粗盐中NaCl的质量分数。
(1)步骤②③中都用到同一仪器(填名称) ____________;目的分别是________________________________,________________________________。
(2)步骤④中洗涤沉淀目的是为了洗去沉淀表面吸附的______________________;如何判断沉淀是否已洗涤干净______________________________________________。
【反思与交流】有同学认为,向滤出沉淀得到的滤液中加入稀盐酸,凋节pH=7,然后移入蒸发皿蒸发,得到纯净NaCl固体.由此也可计算出粗盐中NaCl的质量分数。这个方案如果可行,浓缩蒸发溶液时要用到玻璃棒,其作用是________________________________;如果不可行,理由是_______________________________________________________ (若认为可行,可不填)。
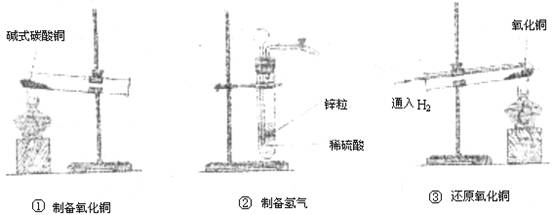
查阅资料:Cu2(OH)2CO3受热易分解生成氧化铜和水同时放出二:氧化碳,氢气可以还原氧化铜得到金属铜。
(1)实验①中判断碱式碳酸铜已经完全分解的依据是_____________________,发生反应的方程式为_______________________________________________。
(2)实验②制备氢气时,应如何检验气密性______________________________________________________________________________。
(3)制备的氢气必须检验纯度,还原氧化铜时必须通入氢气一段时间后才能加热,目的都是为了________________________________。还原氧化铜制得铜的化学方程式为________________________________。待黑色氧化铜粉末完全变红后,停止加热,继续通入氢气至试管冷却是为了防止___________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com