
23.(8分)晓明同学在实验室做实验时,不小心将酚酞试液滴入了盛有碳酸钾溶液的试管中,意外地发现溶液的颜色变红了,他联想到刚学过的碳酸钠溶液也能使酚酞试液变红,于是他进行了下列探究。
实验一:重复进行上述实验,用一洁净的试管取少量纯净的碳酸钾溶液,滴加酚酞试液,酚酞试液变红;用pH试纸测试,该溶液的pH为11。
【提出问题】碳酸钾、碳酸钠都属于“盐”类,你认为晓明最想探究的问题是 ;
【假设猜想】实验开始出现的现象,你对溶液变红的原因有哪些猜测:
猜测一: ;
猜测二: ;
猜测三: ;
(1)、晓明进行实验一的目的是 ;
(2)、由实验一得出的结论是 ;
【实验验证】晓明同学为了证明自己的猜想,又进行了下列实验。
实验二:分别测试纯净的碳酸钠、氯化钠、硫酸铜、硫酸钠、氯化铁、硝酸钾溶液的pH,其结果纪录如下
盐
Na2CO3
NaCl
CuSO4
Na2SO4
FeCl3
KNO3
pH
10
7
4
7
3
7
(3)、由实验二得出的结论是
。
【结论与解释】通过晓明的实验探究,你认为开始的实验现象解释的原因是
。
五、计算题(本题只有1个小题,共6分)
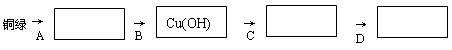
(2)(2分)写出A操作过程中涉及的反应的化学方程式 。
(3)如果实验装置及生成铜以前的操作都正确,但最后没有生成铜,这是因为 。
22.(5分)铜绿的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它能跟酸反应生成铜盐、水和二氧化碳。某同学用小刀把家中旧铜器上的铜绿刮下,用来依次制取较纯净的硫酸铜、氧化铜和铜(为避免掺入固体杂质,他没有采用金属或碳置换化合物中的铜的方法)。制取步骤分为四步:(1)填写下面表示制取步骤的方框图(方框内填写所制取物质的化学式)。

① ② ③ ④
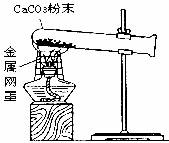
(2)若给上图实验装置增加下列仪器中的 (填序号),就可以直接根据实验现象判断CaCO3是否分解。
21.(7分)某化学实验小组在实验室用下图装置做CaCO3受热分解的实验。加热一段时间后,同学们对试管内剩余固体的成分进行探究。请你参与探究。
【提出问题】加热CaCO3后残留的固体成分是什么?
【作出猜想】
猜想1:CaCO3完全分解,固体成分为 CaO,则反应方程式为 ;猜想2:CaCO3未完全分解,固体成分为CaO、CaCO3;
猜想3:CaCO3未分解,固体成分为CaCO3。
【实验与事实】
(1)甲同学取少量残留固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液,溶液变红。
(2)乙同学取少量残留固体于试管中,先加适量水振荡后静置,再滴几滴无色酚酞试液,溶液变红。接着加过量稀盐酸,有气泡生成,该反应的化学方程式是 。反应过程中固体逐渐消失。你认为还应该看到的现象是 。
【结论与交流】
甲同学认为猜想1成立,他的结论是 (填“合理”或“不合理”)的。你认为猜想 成立。
【拓展与迁移】
(1)酒精灯放置金属网罩的目的是 。
20.(4分)目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物。使用时打开隔离层,即发生以下反应:Mg+2H2O=X+H2↑。请根据以上信息回答下列各题:
(1)该饭盒底部“即热”的原理是将 能转化为热能;
(2) X的化学式是 ,你推断X的化学式的依据 ;
(3)上述化学反应属于 (填写基本反应类型)。
【提出问题】各化工厂排放废水中主要成分是什么?
【进行假设】假设工厂排放的废水含一种溶质.其它成分忽略不计。
【走访调查】
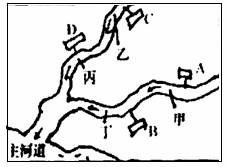
经调查得知:这些小化工厂排放的废水分别含有K2CO3 、NaOH、Fe2(SO4)3 、HCl溶质的废水。观察水渠时发现:甲处河水浅黄色,丙处河水产生气泡,并检测乙处的河水pH>7。
【反思交流】(1)确定工厂排放废水中的主要溶质是B________,C________;D____ .
(2)其中造纸厂可能是_________(填A、或B、或C、或D)厂,你判断的理由是__________
。
【拓展应用】在工厂不迁移的前提下,请你提出有效防止河流污染的方法是:
_______________________________________________________
。
19.(6分)上个世纪80年代中期.上海中部的苏州河附近分布着机械、造纸、化肥、电镀等工厂,河水污染严重,如图主河道的附近有两条支流水渠分布着四家小化工厂A、B、C、D.为了确定四家工厂排放废水中所含有的主要成分,请你跟随环保人员一起探究:
18.(3分)有一包白色粉末,可能是氯化银、碳酸钠、氢氧化镁、氯化钡、硫酸钠、硝酸钠中的一种或几种的混合物,现做如下实验:
①将少量粉末放在烧杯中,加足量水,搅拌、静置、过滤,得无色溶液及白色沉淀;②向过滤所得沉淀中加足量稀硝酸,沉淀全部溶解且无气体产生;③向滤液中滴加硝酸银溶液,有白色沉淀生成再加稀硝酸,沉淀不溶解.根据以上实验现象推断,白色粉末中一定存在___ _;一定不存在_ ___;可能存在___ _.(填写化学式)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com