
| 在下列反应中,不是置换反应的是 |
A.Fe + H2SO4 = FeSO4 + H2↑ B.4H2 + Fe3O4 = 3Fe + 4H2O C.3C + 2Fe2O3 = 4Fe + 3CO2↑ D.3CO + Fe2O3 = 2Fe + 3CO2 |
科目:初中化学 来源:江苏省期末题 题型:单选题
科目:初中化学 来源:不详 题型:单选题
| A.Fe+CuSO4═FeSO4+Cu | B.Fe+H2SO4═H2↑+FeSO4 |
| C.CO+CuO═CO2+Cu | D.H2+CuO═Cu+H2O |
科目:初中化学 来源:荆州市2006年初中毕业班第二次调研考试化学试题 题型:013
已知下列四个反应在一定的条件下都能发生,其中不属于置换反应的是
A.Fe+CuSO4→FeSO4+Cu
B.Fe+H2SO4→H2↑+FeSO4
C.CO+CuO→CO2+Cu
D.H2+CuO→H2O+Cu
科目:初中化学 来源: 题型:
科目:初中化学 来源: 题型:

| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | ||||||||
| ||
| ||
科目:初中化学 来源: 题型:填空题
(12分)铁及其化合物在生活生产中有重要的应用。请回答下列问题:
(1)铁制品在空气中易锈蚀,其实质是铁与空气中的氧气、 等接触后发生化学反应的过程。
(2)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是 。为防止集气瓶破裂,常采取的措施是 。
(3)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生; 乙同学向滤液中滴加稀盐酸,产生白色沉淀。根据两同学实验的现象,分析下列结论不正确的是 (填写字母序号)。
A.滤渣中只含银 B.滤渣中一定含有银,可能含有铜
C.滤液中一定有Ag+ 、Fe2+ 和Cu2+ D.滤液中只含Ag+ 和Fe2+,不含Cu2+
【探究】废旧金属的回收利用。
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),生产动物饲料添加剂硫酸亚铁的工艺之一如下图所示: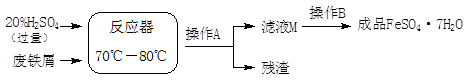
(4)在反应器中发生反应的化学方程式有:
Fe + H2SO4 =FeSO4 +H2↑、 、 Fe2(SO4)3 + Fe = 3FeSO4。
(5)滤液M中肯定含有的溶质的化学式是 ;
(6)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应。下列反应类型肯定属于氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
(7)取表面含有氧化镁的镁条(无其它杂质)2.5g,加入到足量的20.0g的稀硫酸中,充分反应后,所得溶液的质量为22.3g。求:该镁条中单质镁的质量分数。
科目:初中化学 来源:不详 题型:填空题

科目:初中化学 来源: 题型:
 在溶液中较难制得纯净的Fe(OH)2,原因是Fe(OH)2不稳定,在水中只要有一点氧气就极易生成红褐色沉淀Fe(OH)3,其反应的化学方程式4Fe(OH)2+O2+2X═4Fe(OH)3则X是
在溶液中较难制得纯净的Fe(OH)2,原因是Fe(OH)2不稳定,在水中只要有一点氧气就极易生成红褐色沉淀Fe(OH)3,其反应的化学方程式4Fe(OH)2+O2+2X═4Fe(OH)3则X是科目:初中化学 来源: 题型:阅读理解
 金属是一类重要的材料,人类的生活和生产都离不开金属.
金属是一类重要的材料,人类的生活和生产都离不开金属.
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com