
| 下列说法中正确的是 |
A.1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热 B.用渗析法可除去鸡蛋白溶液中少量的氯化钠杂质 C.铝粉与氧化铁粉末反应中生成物总能量高于反应物总能量 D.H2S的热稳定性小于H2O是由于H2S分子间不存在氢键 |
科目:高中化学 来源:河北省期末题 题型:单选题
科目:高中化学 来源: 题型:
下列说法中正确的是
A.1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热
B.用渗析法可除去鸡蛋白溶液中少量的氯化钠杂质
C.铝粉与氧化铁粉末反应中生成物总能量高于反应物总能量
D.H2S的热稳定性小于H2O是由于H2S分子间不存在氢键
科目:高中化学 来源:0103 期末题 题型:单选题
科目:高中化学 来源: 题型:阅读理解
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)近年来,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断:
当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气:
。
(2)次氯酸盐的氧化性较强,可在碱性环境中将许多物质氧化,例如可用其将Fe3+氧化为新型杀菌消毒剂FeO42-,写出该反应的离子方程式 。
(3)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:
W(s)+I2(g)![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。
|
|
|
|
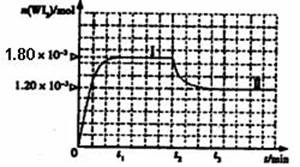
则:①该反应的△H 0(填“>” 或“=”或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(4)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液后,溶液中离子浓度由大到小的顺序是 。
[不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(5)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl2(g)=MgCl2(s) △H= —641kJ/mol ②Ti(s)+2Cl2(g)=TiCl4(l) △H= —770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
科目:高中化学 来源: 题型:阅读理解
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)近年来,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断:
当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气:
。
(2)次氯酸盐的氧化性较强,可在碱性环境中将许多物质氧化,例如可用其将Fe3+氧化为新型杀菌消毒剂FeO42-,写出该反应的离子方程式 。
(3)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:
W(s)+I2(g)![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。ks*5*u
|
|
|
|
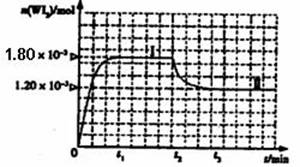
则:①该反应的△H 0(填“>” 或“=”或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(4)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液后,溶液中离子浓度由大到小的顺序是 。
[不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(5)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl2(g)=MgCl2(s) △H= —641kJ/mol ②Ti(s)+2Cl2(g)=TiCl4(l) △H= —770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
科目:高中化学 来源: 题型:阅读理解
 研究硫及其化合物性质有重要意义.
研究硫及其化合物性质有重要意义.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com