
| 不定项 |
| 在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应: M(g)+N(g)  E(g);当反应进行到4min时达到平衡,此时测知M的浓度为0.2mol·L-1。下列说法正确的是 E(g);当反应进行到4min时达到平衡,此时测知M的浓度为0.2mol·L-1。下列说法正确的是 |
A.4min时,M的转化率为80% B.4min时,用M表示的反应速率为0.8mol·L-1·min-1 C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小 D.2min时,M的物质的量浓度为0.6mol·L-1 |
科目:高中化学 来源: 题型:
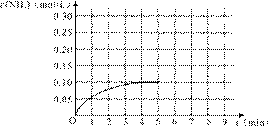
在容积为2L的密闭容器内加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)+Q(Q>0)。反应中NH3的物质的量浓度随时间的变化情况如图:
2NH3(g)+Q(Q>0)。反应中NH3的物质的量浓度随时间的变化情况如图:
31.从反应开始到平衡时,平均反应速率v(NH3)为_______________。
32.若改变某一条件使平衡向正反应方向移动,则v(正) (选填序号,下同)。
a.不变 b.减小
c.增大 d.均有可能
33.下列各项能够说明反应达到平衡的是___________。
a.n(N2)和n(H2)之比保持不变 b.容器内的压强保持恒定不变
c.n(NH3)和n(N2)之比保持不变 d.容器中物质的总质量保持不变
34.第5min,若改变反应温度,则NH3的浓度不可能为 mol·L-1。
a. 0.40 b.0.12 c.0.10 d.0.08
35.在第5min将容器压缩一半体积,若在第8min达到新的平衡(NH3的浓度约为0.25 mol·L-1),请在上图中画出第5~9分钟内NH3浓度的近似变化曲线。
科目:高中化学 来源: 题型:阅读理解
(19分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡___ __(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 | CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 |
请选择正确的序号填空(不定项选择)
① c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
②p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
③ a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
科目:高中化学 来源: 题型:阅读理解
(21分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡_____(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 | CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 |
请选择正确的序号填空(不定项选择)
(1)c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
(2)a、b、c的关系表达正确的为________
A c<2|△H| B a+b=|△H| C c=2b
(3)p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
(4)a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
科目:高中化学 来源:2010-2011学年河北省衡水中学高一下学期期末考试化学试卷 题型:填空题
(21分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g) CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 | CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
科目:高中化学 来源:2013届度本溪市高一下学期期末考试化学试卷 题型:填空题
(19分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g) CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
|
温度 |
250°C |
300°C |
350°C |
|
K |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡___ __(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
|
反应物投入量 |
1molCO、2moL H2 |
1molCH3OH |
2molCH3OH |
|
|
平 衡 时 的 数 据 |
CH3OH浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
akJ |
bkJ |
ckJ |
|
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
|
反应物转化率 |
α1 |
α2 |
α3 |
请选择正确的序号填空(不定项选择)
① c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
②p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
③ a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
科目:高中化学 来源:2013届河北省高一下学期期末考试化学试卷 题型:填空题
(21分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g) CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
|
温度 |
250°C |
300°C |
350°C |
|
K |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡_____(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
|
反应物投入量 |
1molCO、2moL H2 |
1molCH3OH |
2molCH3OH |
|
|
平 衡 时 的 数 据 |
CH3OH浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
akJ |
bkJ |
ckJ |
|
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
|
反应物转化率 |
α1 |
α2 |
α3 |
请选择正确的序号填空(不定项选择)
(1)c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
(2)a、b、c的关系表达正确的为________
A c<2|△H| B a+b=|△H| C c=2b
(3)p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
(4)a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
科目:高中化学 来源: 题型:阅读理解
工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)![]() CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得
c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡_____(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 | CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
请选择正确的序号填空(不定项选择)
① c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
② a、b、c的关系表达正确的为________
A c<2|△H| B a+b=|△H| C c=2b
③ p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
④ a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
科目:高中化学 来源: 题型:阅读理解
工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡 (向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度 D.恒容充入H2
E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平衡 时的 数据 | CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
请选择正确的序号填空(不定项选择)
①c1、c2、c3的关系表达正确的为
A.c3>2c1 B.c1<c3<2c1 C.c1=c2
②a、b、c的关系表达正确的为
A.c<2|△H| B.a+b=|△H| C.c=2b
③p1、p2、p3的关系不正确的为
A.p1=p2 B.p2<p3<2p2 C.p3>2p2
④α1、α2、α3的关系表达不正确的为
A.α1=α2 B.α3<α2 C.α1+α2=1
科目:高中化学 来源: 题型:阅读理解
 CH3OH(g)△H
CH3OH(g)△H| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
| V2 |
| a2 |
| V2 |
| a2 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 |
CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
科目:高中化学 来源:不详 题型:问答题

| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 |
CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com