
科目:高中化学 来源: 题型:
| 选项 | 叙述I | 叙述II |
| A | 除去SO2中的少量CO2,可以通过盛有饱和NaHCO3溶液的洗气瓶 | H2SO3的酸性比H2CO3的酸性强 |
| B | Al2O3的熔沸点很高 | Al2O3可以与NaOH反应 |
| C | Fe(OH)3胶体有丁达尔效应 | Fe(OH)3胶体可以用FeCl3浓溶液与NaOH溶液反应制得 |
| D | NH4Cl为强酸弱碱盐 | NH4Cl溶液显酸性 |
| A、A | B、B | C、C | D、D |
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
科目:高中化学 来源: 题型:
A、B、C、D、E是中学化学常见的5种化合物,其中A、B是氧化物。单质X、Y是生活中常见的金属,相关物质间的转化关系如图所示(部分反应物与产物已略去):

(1)若试剂1与试剂2不属于同类物质,则X与试剂1反应的离子方程式是
________________________________________________________________________;
(2)若试剂1和试剂2相同,且E溶液加热蒸干并灼烧后可得到A,则A的化学式是_________;
①检验物质D的溶液中金属离子的实验操作是______________________________________;
②将物质C溶于水,其溶液呈________(填“酸性”、“中性”或“碱性”),原因用离子方程式可表示为________________________________________;
(3)若E溶液隔绝空气加热蒸干后可得到该溶液的溶质,工业上以E、稀硫酸和NaNO2为原料来制备高效净水剂Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_________________。
(4) 将某份X、Y合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中X、Y物质的量之比为 。
科目:高中化学 来源: 题型:
短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物。
(1)写出E的单质与A、D两元素形成其常见化合物反应的离子方程_________________。
(2)由A、C、D三元素所形成的常见盐溶液呈_________性(填“酸”、“中”、“碱”),其原因用离子方程式表示为:__________________________________________。
(3)B的相对分子质量最小的氢化物的燃烧热为890.3kJ?mol-1,写出其燃烧时的热方程式____________________。
![]() (4)X是含有A、C两元素的化合物,在工业上用X和空气(空气中氧气的体积分数为0.2)为原料生产盐Z的过程如下:
(4)X是含有A、C两元素的化合物,在工业上用X和空气(空气中氧气的体积分数为0.2)为原料生产盐Z的过程如下:
![]()

(a)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为________________________。
(b)若不考虑副反应且各步反应均完全,为使生产盐Z的过程中不再补充空气,则原料气中X的体积分数最大值为多少?(要求写出计算过程)
科目:高中化学 来源: 题型:
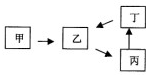 甲、乙、丙、丁四种物质有如图所示的转化关系,已知甲是地壳中含量最高的元素组成的单质,常见化合物乙、丙、丁均含有短周期一种相同元素(除组成甲的元素外).
甲、乙、丙、丁四种物质有如图所示的转化关系,已知甲是地壳中含量最高的元素组成的单质,常见化合物乙、丙、丁均含有短周期一种相同元素(除组成甲的元素外).科目:高中化学 来源: 题型:阅读理解
科目:高中化学 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:填空题
现有A、B、C、D四种短周期元素,它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
元素 相关结构和性质
A 其单质的一种晶体不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷灌和电极材料等。
B 其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小。
C 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多。
D 原子核外最外层电子排布式为nsnnp2n+1
(1)表中所述A的单质晶体中微粒间的相互作用有_____________、_____________。
(2)B元素的氧化物所对应的晶体属于____晶体(填“分子”、“原子”、“离子”、“金属”),工业上制备B元素单质的化学方程式:_______________________。
(3)钠与C元素形成的Na3C晶体中,C元素以C3-存在,C3-的电子排布式为_____________。C元素的气态氢化物溶于水后溶液呈碱性的原因(用方程式表示)_____________(填序号)。
(4)与D同主族的短周期元素,其单质及其化合物与D的单质及化合物均具有的性质为____ (填序号)。
A.常温下单质跟水剧烈反应并放出氧气 B.气态氮化物具有很强的热稳定性
C.气态氢化物极易溶于水并呈强酸性 D.在HXO中X的化合价均为+l价
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关结构和性质 |
| A | 其单质的一种晶体不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷灌和电极材料等。 |
| B | 其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小。 |
| C | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多。 |
| D | 原子核外最外层电子排布式为nsnnp2n+1 |
科目:高中化学 来源: 题型:阅读理解
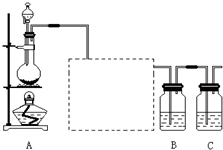 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com