
在一定温度下,将物质的量都为2 mol的A和B充入一密闭容器中,发生如下反应:A(g)+2B(g) 2C(g)。反应达到平衡时,C的物质的量为1.6 mol,则此时A的转化率为 2C(g)。反应达到平衡时,C的物质的量为1.6 mol,则此时A的转化率为 |
A.30% |
科目:高中化学 来源:0118 月考题 题型:单选题
 2C(g)。反应达到平衡时,C的物质的量为1.6 mol,则此时A的转化率为
2C(g)。反应达到平衡时,C的物质的量为1.6 mol,则此时A的转化率为 A.30%
B.40%
C.50%
D.80%
科目:高中化学 来源: 题型:
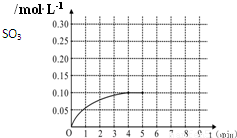
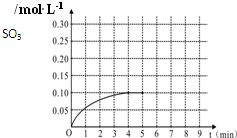 一定温度下,将0.4molSO2和0.2molO2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:
一定温度下,将0.4molSO2和0.2molO2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:科目:高中化学 来源:2012-2013学年陕西师大附中高三(上)期中化学试卷(解析版) 题型:解答题
科目:高中化学 来源:2011-2012学年辽宁省沈阳二中高一下学期期中考试化学试卷(带解析) 题型:实验题
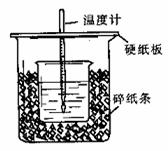
(8分)用一定浓度的稀盐酸与稀NaOH溶液在左下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。已知强酸与强碱的中和热为57.3KJ/mol,水的比热容为4.2J/(g·℃),有关热量与比热容的计算公式:Q=m×c×△t(Q为热量,m为物质的质量,c为比热容,△t物质温度的变化值)
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
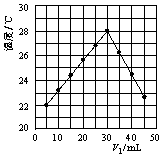
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。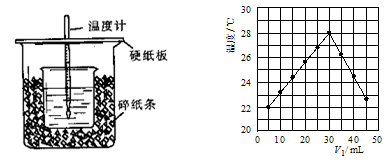
下列叙述正确的是
| A.做该实验时环境温度为22 ℃ | B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约是1.00 mol/L | D.该实验表明有水生成的反应都是放热反应 |
科目:高中化学 来源:2014届辽宁省高一下学期期中考试化学试卷(解析版) 题型:实验题
(8分)用一定浓度的稀盐酸与稀NaOH溶液在左下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。已知强酸与强碱的中和热为57.3KJ/mol,水的比热容为4.2J/(g·℃),有关热量与比热容的计算公式:Q=m×c×△t(Q为热量,m为物质的质量,c为比热容,△t物质温度的变化值)
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
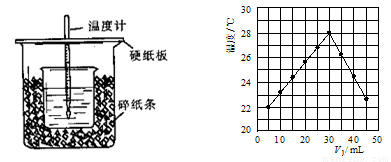
下列叙述正确的是
A.做该实验时环境温度为22 ℃ B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L D.该实验表明有水生成的反应都是放热反应
(3)V1=30mL时HCl和NaOH恰好反应,根据题中所给数据算出的温度变化值约为
(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7 ℃;两者相比所测结果偏低,造成如此现象的原因有:
科目:高中化学 来源: 题型:
用一定浓度的稀盐酸与稀NaOH溶液在左下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。已知强酸与强碱的中和热为57.3KJ/mol,水的比热容为4.2J/(g·℃),有关热量与比热容的计算公式:Q=m×c×△t(Q为热量,m为物质的质量,c为比热容,△t物质温度的变化值)
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
下列叙述正确的是
A.做该实验时环境温度为22 ℃ B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L D.该实验表明有水生成的反应都是放热反应
(3)V1=30mL时HCl和NaOH恰好反应,根据题中所给数据算出的温度变化值约为
(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7 ℃;两者相比所测结果偏低,造成如此现象的原因有:
科目:高中化学 来源:不详 题型:实验题

| A.做该实验时环境温度为22 ℃ | B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约是1.00 mol/L | D.该实验表明有水生成的反应都是放热反应 |
科目:高中化学 来源:辽宁省沈阳二中2011-2012学年高一下学期期中考试化学试题 题型:058
用一定浓度的稀盐酸与稀NaOH溶液在下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.已知强酸与强碱的中和热为57.3 KJ/mol,水的比热容为4.2 J/(g·℃),有关热量与比热容的计算公式∶Q=m×c×Δt(Q为热量,m为物质的质量,c为比热容,Δt物质温度的变化值)
回答下列问题∶
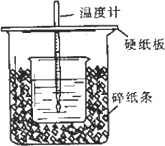
(1)从实验装置上看,图中尚缺少的一种玻璃用品是∶________
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL).

下列叙述正确的是________
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L
D.该实验表明有水生成的反应都是放热反应
(3)V1=30 mL时HCl和NaOH恰好反应,根据题中所给数据算出的温度变化值约为________(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7℃;两者相比所测结果偏低,造成如此现象的原因有∶________
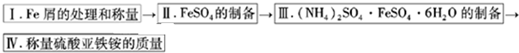
科目:高中化学 来源: 题型:阅读理解
| 温度℃ | FeSO4?7H2O | (NH4)2SO4 | |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78,0 | 28.1 |
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | FeSO4?7H2O | (NH4)2SO4 | (NH4)2SO4?FeSO4?6H2O |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78.0 | 28.1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com