
| V L Fe2(SO4)3溶液中含有a g SO42-,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量的浓度为 |
A.  mol·L-1 mol·L-1B.  mol·L-1 mol·L-1C.  mol·L-1 mol·L-1D.  mol·L-1 mol·L-1 |
科目:高中化学 来源:2013-2014学年陕西省西安市高三上学期期中考试化学试卷(解析版) 题型:选择题
v L Fe2(SO4)3溶液中含有a g SO42-,取此溶液0.5v L,用水稀释至2v L,则稀释后溶液中Fe3+的物质的量浓度为
A.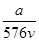 mol·L-1
B.
mol·L-1
B. mol·L-1
mol·L-1
C.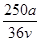 mol·L-1
D.
mol·L-1
D.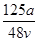 mol·L-1
mol·L-1
科目:高中化学 来源:2011-2012年呼伦贝尔市高二下学期期末考试化学试卷(解析版) 题型:选择题
V L Fe2(SO4)3溶液中含有a g SO42—,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量的浓度为

科目:高中化学 来源: 题型:单选题
v L Fe2(SO4)3溶液中含有a g SO42-,取此溶液0.5v L,用水稀释至2v L,则稀释后溶液中Fe3+的物质的量浓度为
A.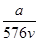 mol·L-1 mol·L-1 | B.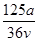 mol·L-1 mol·L-1 |
C.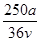 mol·L-1 mol·L-1 | D.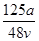 mol·L-1 mol·L-1 |
科目:高中化学 来源:不详 题型:单选题
A. mol·L-1 mol·L-1 | B.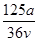 mol·L-1 mol·L-1 |
C.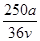 mol·L-1 mol·L-1 | D. mol·L-1 mol·L-1 |
科目:高中化学 来源:不详 题型:单选题

科目:高中化学 来源:同步题 题型:单选题
 mol·L-1
mol·L-1 mol·L-1
mol·L-1 mol·L-1
mol·L-1 mol·L-1
mol·L-1 科目:高中化学 来源:2011-2012年呼伦贝尔市牙克石林业一中高二下学期期末考试化学试卷(带解析) 题型:单选题
V L Fe2(SO4)3溶液中含有a g SO42—,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量的浓度为
科目:高中化学 来源:浙江省平湖中学2008-2009学年高一10月月考化学试卷 人教版 人教版 题型:013
|
V L Fe2(SO4)3溶液中含有a g SO42-,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量的浓度为 | |
| [ ] | |
A. |
|
B. |
|
C. |
|
D. |
|
科目:高中化学 来源:福建省厦门一中2011-2012学年高一上学期期中化学试题 题型:013
|
V L Fe2(SO4)3 溶液中含有a g SO42-,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+ 的物质的量的浓度为 | |
| [ ] | |
A. |
|
B. |
|
C. |
|
D. |
|
科目:高中化学 来源: 题型:
(15分)我国钛铁矿(主要成分为FeTiO3,还含有Al2O3、SiO2等)的储量居世界首位,用钛铁矿制取TiO2和副产品硫酸亚铁晶体的的流程如下:

已知:Al(OH)3的Ksp= 1.3ⅹ10-33,Fe(OH)2的Ksp= 1.6ⅹ10-14。
(1)滤液I主要含有TiO2+、SO42—、Fe2+、 (填离子符号);
(2)调节PH应最好使用 ;
A.Fe B.Ca(OH)2 C.NH3•H2O D.NaOH
(3)操作II是指 洗涤、干燥。
(4)步骤②中发生的化学反应方程式为: ;考虑成本和废物综合利用等因素,生产过程中产生的废液中应加入 处理较合理。
(5)实验室通常将硫酸亚铁进一步制备为硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]以利保存,制备方法被收入中学《实验化学》教材中;专家测定晶体含量的办法是:准确称取m g产品溶解定容至250.00ml,移取25.00ml于锥形瓶中,用c mol·L-1的标准KMnO4溶液滴定至 ,记录消耗KMnO4溶液的体积为V mL;此时发生的反应为:
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O,(已知硫酸亚铁铵晶体的相对分子质量为392),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com