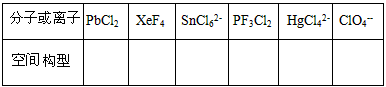| 用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是 |
A.NH4+为正四面体形
B.CS2为直线形
C.HCN为折线形(V形)
D.PCl3为三角锥形 |
相关习题
科目:高中化学
来源:2012-2013学年四川省绵阳市南山中学高二12月月考化学试卷(带解析)
题型:单选题
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
| A.SO2直线形 | B.CS2平面三角形 |
| C.NH+4正四面体形 | D.BF3三角锥形 |
查看答案和解析>>
科目:高中化学
来源:2014届四川省绵阳市高二12月月考化学试卷(解析版)
题型:选择题
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
A.SO2
直线形
B.CS2 平面三角形
C.NH+4 正四面体形
D.BF3 三角锥形
查看答案和解析>>
科目:高中化学
来源:不详
题型:单选题
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
| A.SO2直线形 | B.CS2平面三角形 |
| C.NH+4正四面体形 | D.BF3三角锥形 |
查看答案和解析>>
科目:高中化学
来源:不详
题型:单选题
用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )
| A.NH4+为正四面体形 | B.CS2为直线形 |
| C.HCN为折线形(V形) | D.PCl3为三角锥形 |
查看答案和解析>>
科目:高中化学
来源:
题型:单选题
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
- A.
SO2直线形
- B.
CS2平面三角形
- C.
NH+4正四面体形
- D.
BF3三角锥形
查看答案和解析>>
科目:高中化学
来源:同步题
题型:单选题
用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是
A.NH4+为正四面体形
B.CS2为直线形
C.HCN为折线形(V形)
D.PCl3为三角锥形
查看答案和解析>>
科目:高中化学
来源:
题型:单选题
用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )
| A.NH4+为正四面体形 | B.CS2为直线形 |
| C.HCN为折线形(V形) | D.PCl3为三角锥形 |
查看答案和解析>>
科目:高中化学
来源:同步题
题型:填空题
20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ.用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ.分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ.分子中价层电子对之间的斥力主要顺序为:
i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;
iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表
(2)请用VSEPR模型解释CO2为直线型分子的原因_________________;
(3)H2O分子的立体构型为:_________________,请你预测水分子中∠H-O-H的大小范围并解释原因_________________;
(4)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测SO2Cl2和SO2F2分子的立体构型:_________________,SO2Cl2分子中∠Cl-S-Cl___________(选填“<”、“>”或“=”)SO2F2分子中∠F-S-F。
(5)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
查看答案和解析>>
科目:高中化学
来源:同步题
题型:填空题
20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ.用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间;
Ⅱ.分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ.分子中价层电子对之间的斥力主要顺序为:
i.孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii.双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii.X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;
iV.其他。
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表
(2)请用VSEPR模型解释CO2为直线形分子的原因______________;
(3)H2O分子的立体构型为:______,请你预测水分子中∠H-O-H的大小范围并解释原因_____________;
(4)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测
SO2Cl2和SO2F2分子的立体构型:__________________,SO2Cl2分子中∠Cl-S-Cl ____(填“<”、“>”或“=”)SO2F2分子中∠F-S-F。
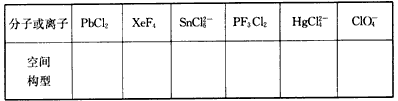
(5)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
查看答案和解析>>
科目:高中化学
来源:0104 期中题
题型:填空题
20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:
i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;
iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表
(2)请用VSEPR模型解释CO2为直线型分子的原因________________________;
(3)H2O分子的立体构型为:____________,请你预测水分子中∠H-O-H的大小范围__________;
(4)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测SO2Cl2和SO2F2分子的立体构型:______________, SO2Cl2分子中∠Cl-S-Cl (选填“<”、“>”或“=”)_______SO2F2分子中∠F-S-F。
(5)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
查看答案和解析>>