
| 当酸碱恰好完全中和时,下列叙述中正确的是 |
A、反应的离子方程式为:H++OH-==H2O B、加入酸的浓度、体积与加入碱的浓度、体积相等 C、酸中的c(H+)与加入碱的c(OH-)相等 D、加入酸提供的n(H+)与加入碱提供的n(OH-)相等 |
科目:高中化学 来源:北京期末题 题型:单选题
科目:高中化学 来源: 题型:
下列实验操作或对实验事实的叙述正确的是 (填序号)。
A.使用苯酚溶液时不小心沾到皮肤上,应立即用氢氧化钠溶液洗涤,再用水冲洗;
B.除去乙烷中的乙烯,可通入H2、并在适当催化剂的催化下反应而实现;
C.将0.5 g淀粉加入盛有5 mL 20%的硫酸溶液的试管中,经沸水浴加热5 min后用碱中和硫酸,再加入碱性氢氧化铜悬浊液,水浴加热,可看到红色沉淀;
D.向盛有1mL 2%的AgNO3溶液的试管中,边滴加2%稀氨水边振荡,至产生的沉淀恰好完全溶解,得到的溶液为银氨溶液。
科目:高中化学 来源: 题型:021
当酸跟碱恰好完全中和时,则下列各项叙述中正确的是
[ ]
A.所得溶液是中性的B.溶液中的[![]() ]与[
]与[![]() ]相等
]相等
C.加入的酸提供的![]() 与加入的碱提供的
与加入的碱提供的![]() 肯定相等
肯定相等
D.加入的酸的物质的量与加入碱的物质的量一定相等
科目:高中化学 来源: 题型:
(10分)工业上通常把溶液中存在的CO32- 和HCO3-的总浓度称为总碱度。水中碱度的控制成为碳酸钠软化水处理法的关键。碳酸在水中一般以3种形态存在,即H2CO3(CO2)、CO32- 和HCO3-。当溶液的pH发生变化时,其中任一种形态的物质的量占三种形态总物质的量的分数δ也可能发生变化,下图是碳酸溶液中碳酸的各种形态的δ随pH的变化曲线。
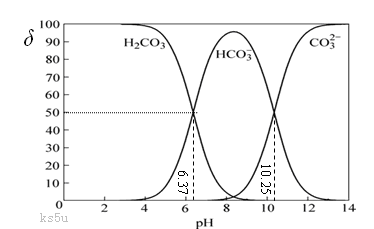
(1)从图中推断NaHCO3溶液呈 (填“酸”、“碱”、或“中”)性,其原因是
(用离子方程式表示)。
(2)正常情况下,人体血液的pH维持在7.35~7.45之间,则溶于血液中的二氧化碳的主要存在形式是 。(填写微粒化学式)
(3)根据上图,下列叙述中正确的是 。
A.HCO3-既能与强酸反应又能与强碱反应。
 B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性
B.盐酸逐滴滴入碳酸钠溶液至恰好完全反应时溶液呈中性
C.pH小于7的雨水称为酸雨
D.在pH为6.37时,溶液中的c (H2CO3)= c (HCO3-)
(4)工业用循环冷却水中常含有Ca2+等杂质离子,在循环过程中易结垢,可通过控制溶液的总碱度使Ca2+等离子形成沉渣除去。已知某温度下Ksp(CaCO3)=3.03×10-9,当水中的c(Ca2+)≤3×10-4 mol·L-1时,不会出现结垢现象,则该水中的c(CO32-)应至少为 mol·L-1。
科目:高中化学 来源:同步题 题型:填空题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com