
| 实验室为了完成下列实验,其选用的试剂或操作的方法不正确的是 |
A、除去镁粉中混有少量的铝粉,加入足量的氢氧化钠溶液,过滤、洗涤、干燥 B、除去铁制器皿表面的镀铜层,加入足量的浓硝酸,洗涤、干燥 C、除去甲烷中混有少量的乙烯,将混合气体通入足量的溴水,洗气 D、除去硝基苯中混有的硝酸,加入足量的水,过滤 |
科目:高中化学 来源:2016届四川省广安市高一上学期期末考试化学试卷(解析版) 题型:填空题
Ⅰ.实验室需配制500mL 0.2mol/L NaCl溶液
(1)本实验用到的仪器已有药匙、烧杯、量筒、托盘天平(砝码、镊子)、玻璃棒、胶头滴管,还缺少的玻璃仪器是 。
(2)配制时,需称取NaCl的质量是 g
(3)在配制过程中,其他操作都正确的情况下,下列操作会导致所配制的溶液浓度偏高的是 。(选填序号)
①没有洗涤烧杯和玻璃棒
②加蒸馏水时,不慎超过了刻度,取出少量水使液面恰好到刻度线
③容量瓶不干燥,含有少量蒸馏水
④定容时仰视标线
⑤定容时俯视标线
Ⅱ.(10分)某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
(1)提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2: ;
假设3:催化剂中铁元素既有+3价又有+2价
(2)设计实验方案。
(3)根据(2)的实验方案进行实验:
步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是 ;
步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设 成立;若出现血红色,则假设1或3成立;
步骤4:为了进一步确定步骤3中是假设1还是假设3成立:另取A溶液于试管,加入KMnO4溶液,振荡,若出现 现象,则假设1成立;反之,则假设3成立。
(4)反思
某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论。请判断该结论是否合理
(填“合理”或“不合理”)。
科目:高中化学 来源: 题型:填空题
Ⅰ.实验室需配制500mL 0.2mol/L NaCl溶液
(1)本实验用到的仪器已有药匙、烧杯、量筒、托盘天平(砝码、镊子)、玻璃棒、胶头滴管,还缺少的玻璃仪器是 。
(2)配制时,需称取NaCl的质量是 g
(3)在配制过程中,其他操作都正确的情况下,下列操作会导致所配制的溶液浓度偏高的是 。(选填序号)
①没有洗涤烧杯和玻璃棒
②加蒸馏水时,不慎超过了刻度,取出少量水使液面恰好到刻度线
③容量瓶不干燥,含有少量蒸馏水
④定容时仰视标线
⑤定容时俯视标线
Ⅱ.(10分)某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
(1)提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2: ;
假设3:催化剂中铁元素既有+3价又有+2价
(2)设计实验方案。
(3)根据(2)的实验方案进行实验:
步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是 ;
步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设 成立;若出现血红色,则假设1或3成立;
步骤4:为了进一步确定步骤3中是假设1还是假设3成立:另取A溶液于试管,加入KMnO4溶液,振荡,若出现 现象,则假设1成立;反之,则假设3成立。
(4)反思
某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论。请判断该结论是否合理
(填“合理”或“不合理”)。
科目:高中化学 来源:不详 题型:填空题
科目:高中化学 来源:北京期末题 题型:单选题
科目:高中化学 来源: 题型:
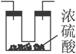
通过仔细分析,该同学重新设计了一套装置(如下图所示)(实验室可供选择的试剂和药品有锌片、浓硫酸、氢氧化钙溶液、碳酸钙固体、蒸馏水)。
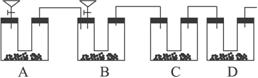
完成下列问题:
(1)请分析在实验改进前,实验中出现较大偏差的原因:______________________________。
(2)在改进后的实验中,A装置分液漏斗中所盛的液体为__________,U形管内盛有。在整套装置中,A的作用是__________________________;D装置中U形管内盛有__________,D装置在整套装置中的作用是_____________________。
(3)该同学新设计的实验装置(如上图所示)是否完整?如果不完整,请画出应该补充的装置简图,并在图中标明所用药品或试剂。
科目:高中化学 来源:2012-2013学年广东省汕头市金山中学高二上学期期末考试化学试卷(带解析) 题型:填空题
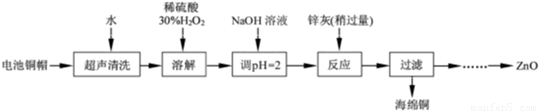
(12分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质。 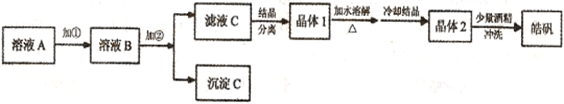 (l)制备皓矾的实验流程如下图所示。
(l)制备皓矾的实验流程如下图所示。
已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
| | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Zn(OH)2 | 5.7 | 8.0 |
科目:高中化学 来源:不详 题型:填空题
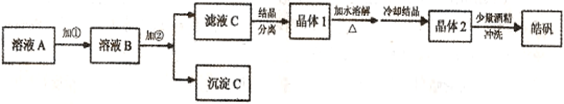 (l)制备皓矾的实验流程如下图所示。
(l)制备皓矾的实验流程如下图所示。| | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Zn(OH)2 | 5.7 | 8.0 |
科目:高中化学 来源:2012年江苏省高考化学试卷(解析版) 题型:填空题
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
科目:高中化学 来源:2011-2012学年江西上饶中学高一零点、实验班下期末化学试卷(带解析) 题型:实验题
(14分)下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇(CH3CH218OH)、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,其中浓硫酸除了作吸水剂的作用外还有
[装置设计]甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是 (选填 “甲”或 “乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管除起冷凝作用外,它的另一重要作用是 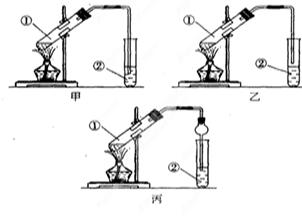
[实验步骤](1)按选择的装置组装仪器,在试管中先加入3mLCH3CH218OH,2mL冰醋酸,并在摇动下缓缓加入2mL浓硫酸充分摇匀, (2)将试管固定在铁架上;(3)在试管②中加人适量的饱和Na2CO3溶液;(4)用酒精灯对试管①加热;(5)当观察到试管②中有明显现象时停止实验。
[问题讨论]a.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:
无色油状液体、 ;
b.试管 ② 中饱和 Na2CO3的作用是溶解乙醇、降低乙酸乙酯的溶解度还有 的作用
c. 从试管②中分离出乙酸乙酯的实验操作是
d. 生成乙酸乙酯的化学反应方程式
科目:高中化学 来源:2014届江西上饶中学高一零点、实验班下期末化学试卷(解析版) 题型:实验题
(14分)下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇(CH3CH218OH)、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,其中浓硫酸除了作吸水剂的作用外还有
[装置设计]甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是 (选填 “甲”或 “乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管除起冷凝作用外,它的另一重要作用是

[实验步骤](1)按选择的装置组装仪器,在试管中先加入3mLCH3CH218OH,2mL冰醋酸,并在摇动下缓缓加入2mL浓硫酸充分摇匀, (2)将试管固定在铁架上;(3)在试管②中加人适量的饱和Na2CO3 溶液;(4)用酒精灯对试管①加热;(5)当观察到试管②中有明显现象时停止实验。
[问题讨论]a.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:
无色油状液体、 ;
b.试 管 ② 中饱 和 Na2CO3 的作用是溶解乙醇、降低乙酸乙酯的溶解度还有 的作用
c. 从试管②中分离出乙酸乙酯的实验操作是
d. 生成乙酸乙酯的化学反应方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com