
| 在甲、乙两烧杯溶液中,分别仅含Cu2+、Na+、H+、SO42-、CO32-、OH-六种离子中的三种。已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是 |
A、Cu2+、H+、SO42- B、SO42-、CO32-、OH- C、Na+、CO32-、OH- D、Na+、H+、SO4- |
科目:高中化学 来源:0103 期中题 题型:单选题
科目:高中化学 来源: 题型:
在甲、乙两烧杯溶液中,分别仅含Cu2+、Na+、H+、SO42-、CO32—、OH—六种离子中的三种。已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
A、Cu2+、H+、SO42- B、SO42-、CO32—、OH—
C、Na+、CO32—、OH— D、Na+、H+、SO42-、
科目:高中化学 来源: 题型:
在甲、乙两烧杯溶液中,分别仅含Cu2+、Na+、H+、SO42-、CO32—、OH—六种离子中的三种。已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
A.Cu2+、H+、SO42- B.SO42-、CO32—、OH—
C.Na+、CO32—、OH— D.Na+、H+、SO42-
科目:高中化学 来源: 题型:
在甲、乙两烧杯溶液中,分别仅含Cu2+、Na+、H+、SO42-、CO32—、OH—六种离子中的三种。已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
A、Cu2+、H+、SO42- B、SO42-、CO32—、OH—
C、Na+、CO32—、OH— D、Na+、H+、SO42-、
科目:高中化学 来源:河北省衡水中学09-10学年高二第二学期期中考试 题型:单选题
在甲、乙两烧杯溶液中,分别仅含Cu2+、Na+、H+、SO42-、CO32—、OH—六种离子中的三种。已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
A、Cu2+、H+、SO42- B、SO42-、CO32—、OH—
C、Na+、CO32—、OH— D、Na+、H+、SO42-、
科目:高中化学 来源: 题型:阅读理解
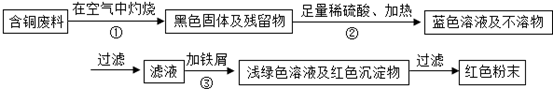
| ||
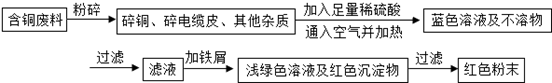
| ||
| ||
科目:高中化学 来源: 题型:阅读理解
| Fe2O3 | CO | Fe | CO2 | |
| 甲 | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| 乙 | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品于烧杯中加适量稀硫酸溶解 | \ |
| 步骤2: 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 |
若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 |
| 步骤3: 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 |
若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 |
| 步骤4: 空 空 |
空 空 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com