
| 下列气体中,不能用98.3%的浓硫酸干燥的是: |
| (1) SO3、(2)SO2、(3)Cl2、(4)H2S A、只有(4) B、(1)和(4) C、(3)和(4) D、(1)(2)(4) |
科目:高中化学 来源: 题型:实验题
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。在纺织工业中用于棉织品漂白后的脱氯剂、染毛织物的硫染剂、靛蓝染料的防白剂、纸浆脱氯剂、医药工业中用作洗涤剂、消毒剂和褪色剂等,它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图: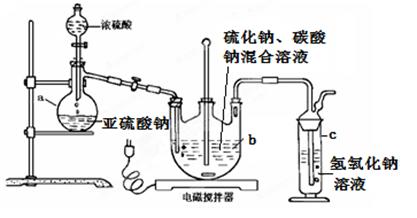
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近7时,停止通入SO2 气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~450C左右干燥50~60min,称量。请回答以下问题:
(1)仪器b的名称是 ;
(2)步骤②中若控制PH值小于7,则产率会下降,请用离子方程式解释原因: 。
(3)步骤③中不能将溶液蒸发至干的原因是 ;晶膜通常在溶液表面出现的原因是 。
(4)步骤④中洗涤硫代硫酸钠晶体试剂的结构式是 。
(5)下列有关抽滤的说法中,正确的是 。
A.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量洗涤液于试管中进行相关实验
B.抽滤前先用溶剂将滤纸湿润,使滤纸与漏斗底部贴紧
C.抽滤结束时应先关抽气泵,后抽掉抽滤瓶接管
D.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(6)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
科目:高中化学 来源: 题型:
| ||

科目:高中化学 来源: 题型:解答题
科目:高中化学 来源:福建省模拟题 题型:实验题
科目:高中化学 来源:安徽省宿州市2008年高三第二次教学质量检测理科综合(化学)试题 题型:058
| |||||||||||||||||||||||||||||||||||||
科目:高中化学 来源: 题型:阅读理解
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O科目:高中化学 来源: 题型:阅读理解
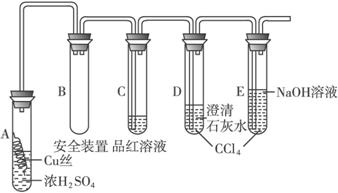
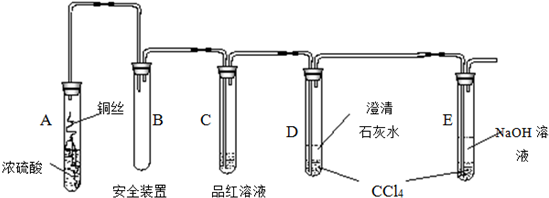
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录:
材料一:小组交流摘录? 学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究! 学生2:我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。? 学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S△Cu2S(黑色)。? 材料二:探究实验剪辑? 实验1:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝插入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。? 实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。? 实验3:将溶液中的黑色颗粒状物质经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。 |
根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是___________________;D、E两支试管中CCl4的作用是___________________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:___________________。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是___________:。设计实验验证你的猜想__________________________________。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是___________________(写化学式)。
科目:高中化学 来源: 题型:阅读理解
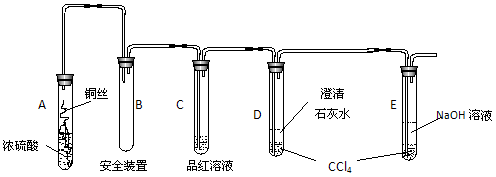
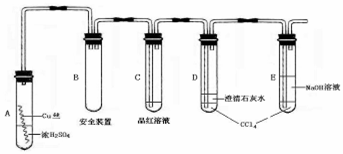
某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端浸入浓H2SO4中,另一端露置在液面上方。以下是该学习小组部分交流记录及后续探究实验的记录:
 |
学生1:加热前,无现象发生;加热后,液面下的铜丝变黑,表面产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的无水CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S→Cu2S(黑色)。
材料二:探究实验剪辑
实验1:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色变浅了些,溶液呈蓝色。
实验3:将溶液过滤得黑色颗粒状物质,经稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少。
| |
(1)A试管上方的长导管的作用是 ;D、E两支试管中CCl4的作用是 。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,并有大量气泡冒出,已知SO2难溶于CCl4中,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是: 。设计实验验证你的猜想 。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 。(写化学式)
科目:高中化学 来源:上海市十三校2012届高三第二次联考化学试题 题型:058
三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷.可用如下流程来制备.
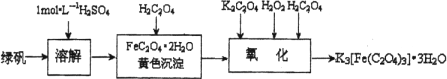
根据题意完成下列各题:
1.若用铁和稀硫酸制备FeSO4·7H2O________(填物质名称)往往要过量,理由是________.
2.要从溶液中得到绿矾,必须进行的实验操作是________.(按前后顺序填)
a.过滤洗涤
b.蒸发浓缩
c.冷却结晶
d.灼烧
e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000 g三草酸合铁酸钾晶体,配制成250 ml溶液.
步骤二:取所配溶液25.00 ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO-4.被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤三:用0.010 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 ml,滴定中MnO4,被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO4溶液19.98 ml;
回答3-6小题:
3.配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有________;主要操作步骤依次是:称量、________、转移、________、定容、摇匀.
4.加入锌粉的目的是________.
5.实验测得该晶体中铁的质量分数为________.在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量________.(选填“偏低”“偏高”“不变”)
6.某同学将8.74 g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42 g,同时得到密度为1.647 g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式________.
科目:高中化学 来源: 题型:阅读理解
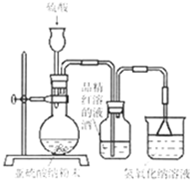 (2012?杭州一模)某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
(2012?杭州一模)某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com