如图是元素周期表的一部分,针对表中的①至⑩号元素,请按照要求回答以下问题.
| 周期 族 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 一 |
① |
|
|
|
|
|
|
|
| 二 |
|
|
|
② |
③ |
④ |
⑤ |
|
| 三 |
⑥ |
|
|
⑦ |
⑧ |
⑨ |
⑩ |
|
(1)①至⑩号元素形成的气态氢化物中最稳定的是
HF
HF
(填氢化物的化学式);
(2)元素②和⑨,非金属性较强的是
硫
硫
(填元素名称),请用一个离子方程式来说明这个结论:
CO32-+2H+═H2O+CO2↑或HCO3-+H+═H2O+CO2↑
CO32-+2H+═H2O+CO2↑或HCO3-+H+═H2O+CO2↑
;
(3)均由①④⑥⑨四种元素组成的两种化合物发生反应,能产生一种气体,该反应的化学方程式是:
NaHSO3+NaHSO4═Na2SO4+H2O+SO2↑
NaHSO3+NaHSO4═Na2SO4+H2O+SO2↑
;
(4)元素④的某一种氢化物常温下呈液态(每个分子由18个电子),将该氢化物滴到氯化亚铁溶液中,溶液的颜色发生明显变化,请写出该反应的离子方程式:
2Fe2++H2O2+2H+═2Fe3++2H20
2Fe2++H2O2+2H+═2Fe3++2H20
;
(5)元素⑥和⑨组成的化合物溶于水,溶液呈
碱性
碱性
(填“酸性”、“中性”或“碱性”),其原因是
S2-+H2O?HS-+OH-
S2-+H2O?HS-+OH-
(用离子方程式表达),溶液中的各种离子按照浓度由大到小排列顺序是:
Na+>S2->OH->HS->H+
Na+>S2->OH->HS->H+
.
(6)能说明非金属性⑤比⑩强的是
AC
AC
.
A.单质与氢气化合,⑤比⑩容易; B.最高价氧化物对应的水化物的酸性,⑤比⑩强;
C.气态氢化物的稳定性,⑤比⑩强; D.单质⑤能在水溶液中置换出单质⑩.
(7)元素⑧与⑩形成的化合物有两种,其中一种化合物各原子最外层均达到了8电子的稳定结构,该化合物的化学式为
PCl3
PCl3
.


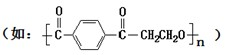 做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是
做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和H2O时,加入试剂的顺序应是