
| 25℃时,在由水电离产生的H+浓度为1×10-13 mol·L-1的溶液中,一定能大量共存的离子组是 |
| ① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3- A.①③ B.③⑤ C.③④ D.②⑤ |
科目:高中化学 来源:天津月考题 题型:单选题
[ ]
科目:高中化学 来源:2011-2012学年天津市高三第一次月考化学试卷 题型:选择题
25℃时,在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
科目:高中化学 来源: 题型:
25℃时,在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
科目:高中化学 来源:2012届天津市天津一中高三第一次月考化学试卷 题型:单选题
25℃时,在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-⑤ K+、Ba2+、Cl-、NO3-
| A.①③ | B.③⑤ | C.③④ | D.②⑤ |
科目:高中化学 来源:专项题 题型:不定项选择题
科目:高中化学 来源: 题型:阅读理解
(12分)七水硫酸镁(MgSO4?7H2O)为白色细小四角柱状结晶,无臭,味苦,在干燥空气中易风化,易溶于水,缓溶于甘油,微溶于乙醇,热至68℃以上熔化。在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣――硼镁泥可制取七水硫酸镁。
表1 硼镁泥的主要化学成分
成分 | MgO | SiO2 | Fe2O3 | CaO | B2O3 | Al2O3 | MnO | CO2 |
质量分数% | 25-38 | 18-25 | 6-15 | 1-3 | 1-2 | 1-2 | 1-2 | 15-20 |
表2 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
硼镁泥制取七水硫酸镁的工艺流程如下
根据以上流程图并参考表格数据,试回答下列问题:
⑴ 硼镁泥是硼镁矿生产硼砂(Na2B4O7?10H2O)时的废渣。将硼镁矿(2MgO?B2O)锻烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。此反应为熵减小反应, 试写出反应方程式: 。
⑵ 沉淀A中除二氧化硅外,还含有硼酸,硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式 。
⑶ CaSO4的溶解度随温度升高变化不明显,在得到沉淀C时,对蒸发浓缩后的溶液却要进行趁热过滤,原因是 。
⑷ 经对沉淀B进行分析,发现其中含有二氧化锰,用方程式解释原因: 。
⑸ 用正三辛胺(TOA)做萃取剂,磺化煤油做稀释剂,通过有机萃取也可以用来除去硫酸镁浸出液中的铁。其主要反应如下:
Fe2++H2O=Fe(OH)2++H+ ⑴
Fe(OH)2++SO42-=Fe(OH)SO4 ⑵
2R3N+H2SO4=(R3NH)2SO4 ⑶
Fe(OH)SO4+(R3NH)2SO4=Fe(OH)SO4?(R3NH)2SO4 ⑷
试问:浸出液初始pH须加H2SO4调至0.9左右,pH>1.5时不利于萃取。试给出须加H2SO4的两个理由
![]() 。
。
![]() pH<0.5亦不利于萃取,给出其主要原因
pH<0.5亦不利于萃取,给出其主要原因 ![]() 。
。
科目:高中化学 来源:模拟题 题型:填空题
研究化学反应原理对于生产生活是很有意义的。
(1)25℃时,醋酸溶液中CH3COOH CH3COO-+ H+;Ka= 1.75×10-5 mol/L,若向0.10 mol/LCH3COOH溶 液中加入一定量的固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0 mol/L,则溶液中c(H+)=_______mol/L(计算结果保留小数点后两位数字)。溶液中各种离子浓度关系是__________。
CH3COO-+ H+;Ka= 1.75×10-5 mol/L,若向0.10 mol/LCH3COOH溶 液中加入一定量的固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0 mol/L,则溶液中c(H+)=_______mol/L(计算结果保留小数点后两位数字)。溶液中各种离子浓度关系是__________。
(2)牙釉质对牙齿起着保护作用,其主要成分为Ca5(PO4)3OH,该物质在水中存在沉淀溶解平衡,试写出该物质的溶度积常数表达式Ksp=_____________。
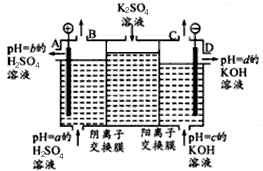
(3)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。
科目:高中化学 来源: 题型:
(8分)现有A、B、C、D、E五种强电解质,他们在水中可电离产生下列离子(每种电解质电离时只产生一种阳离子,而且不重复)。
| 阳离子 | H+、Na+、Al3+、Ag+、 Ba2+ |
| 阴离子 | OH-、 Cl-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性; C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是(用离子方程式表示) ;
(2)写出E溶液与过量B溶液反应的离子方程式 ;
(3)若25℃时C、E溶液PH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度的 倍;
(4)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中反应后溶液中的一价(+1和-1)离子浓度由大到小的顺序为 。
科目:高中化学 来源: 题型:
(10分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。试回答下列问题:
(1)写出化学式:A___________________ D_________________________。
(2)写出A与E反应的离子方程式_____________________________________________。
(3)25℃时将40mL0.01mol·L-1B与20mL0.01mol·L-1C混合,最终溶液pH=____________。
(4)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
科目:高中化学 来源:09~10学年浠水一中高二下学期期中考试化学卷 题型:填空题
(10分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com