
| 不定项 |
| 下列高分子化合物的合成,所发生的化学反应类型与另外三种不同的是 |
A.聚乙烯 B.聚甲基丙烯酸甲酯 C.酚醛树脂 D.聚苯乙烯 |
科目:高中化学 来源:江西省期中题 题型:填空题
 2NH3(g)
2NH3(g) 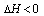 。
。  ,则N2的转化率α1=_____;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2______α1(填“>”、“<”或“=”)。
,则N2的转化率α1=_____;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2______α1(填“>”、“<”或“=”)。  2NO2(g)
2NO2(g) 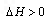 。该反应的反应速率(
。该反应的反应速率( )随时间(t)变化的关系如图所示。若 时刻只改变一个条件,下列说法正确的是(填选项序号)_________。
)随时间(t)变化的关系如图所示。若 时刻只改变一个条件,下列说法正确的是(填选项序号)_________。 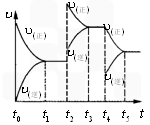
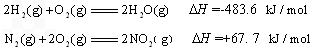
 溶液吸收NO2生成CO2。若
溶液吸收NO2生成CO2。若 和
和 溶液完全反应时转移电子0.1 mol,则反应的离子方程式是______________________。
溶液完全反应时转移电子0.1 mol,则反应的离子方程式是______________________。 科目:高中化学 来源:江西省白鹭洲中学2012届高三上学期期中考试化学试题 题型:022
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气.反应为:N2(g)+3H2(g)![]() 2NH3(g);ΔH<0.
2NH3(g);ΔH<0.
①下列措施可以提高H2的转化率的是(填选项序号)________.
a.选择适当的催化剂
b.增大压强
c.及时分离生成的NH3
d.升高温度
②一定温度下,在密闭容器中充入1 mol N2和3 mol H2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的![]() ,则N2的转化率α1=________;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2________α1(填“>”、“<”或“=”).
,则N2的转化率α1=________;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2________α1(填“>”、“<”或“=”).
(2)以氨气、空气为主要原料制硝酸.
在容积恒定的密闭容器中进行反应2NO(g)+O2(g)![]() 2NO2(g);ΔH>0.
2NO2(g);ΔH>0.
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t2,t4时刻只改变一个条件,下列说法正确的是(填选项序号)________.
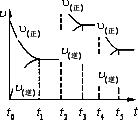
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g);ΔH=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g);ΔH=+67.7 kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是________.
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式是________.
科目:高中化学 来源: 题型:阅读理解
| 通电 |
| 加热 |
科目:高中化学 来源: 题型:阅读理解
(12分)海水是取之不尽用之不竭的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图。
回答下列问题:
(1)请写出电解食盐水的离子方程式 。
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是: 。
②石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是 ;
③电解熔融氯化镁的化学方程式是 ;
④电解无水氯化镁所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可用作镁蒸气的冷却剂是(填写代号) 。
A.H2 B.Cl2 C.空气 D.O2
E.水蒸气
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入一种常见的气态氧化剂,又制取了重要的化工原料溴单质:
①生成溴单质的化学反应的离子方程式是
②以下是对生产溴单质所用的气态氧化剂寻找货源的主凤想,其中合理的是
(填写代号)
A.以外地购买 B.在当地新建生产厂
C.从本厂生产烧碱外循环 D.从木厂生产镁单质处循环
③从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你认为该化工厂还可以再增加的生产项目是 。
科目:高中化学 来源:2010年江西省吉安市高一下学期期末考试化学试题 题型:填空题
(12分)海水是取之不尽用之不竭的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图。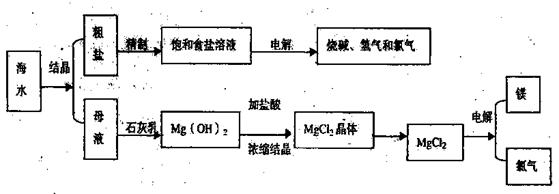
回答下列问题:
(1)请写出电解食盐水的离子方程式 。
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是: 。
②石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是 ;
③电解熔融氯化镁的化学方程式是 ;
④电解无水氯化镁所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可用作镁蒸气的冷却剂是(填写代号) 。
A.H2 B.Cl2 C.空气 D.O2
E.水蒸气
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入一种常见的气态氧化剂,又制取了重要的化工原料溴单质:
①生成溴单质的化学反应的离子方程式是
②以下是对生产溴单质所用的气态氧化剂寻找货源的主凤想,其中合理的是
(填写代号)
A.以外地购买 B.在当地新建生产厂
C.从本厂生产烧碱外循环 D.从木厂生产镁单质处循环
③从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你认为该化工厂还可以再增加的生产项目是 。
科目:高中化学 来源:2010年江西省吉安市高一下学期期末考试化学试题 题型:填空题
(12分)海水是取之不尽用之不竭的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图。
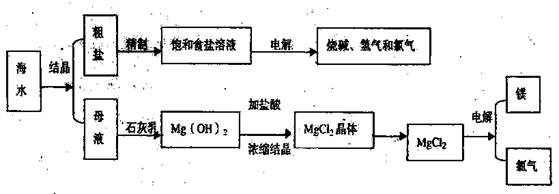
回答下列问题:
(1)请写出电解食盐水的离子方程式 。
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是: 。
②石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是 ;
③电解熔融氯化镁的化学方程式是 ;
④电解无水氯化镁所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可用作镁蒸气的冷却剂是(填写代号) 。
A.H2 B.Cl2 C.空气 D.O2
E.水蒸气
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入一种常见的气态氧化剂,又制取了重要的化工原料溴单质:
①生成溴单质的化学反应的离子方程式是
②以下是对生产溴单质所用的气态氧化剂寻找货源的主凤想,其中合理的是
(填写代号)
A.以外地购买 B.在当地新建生产厂
C.从本厂生产烧碱外循环 D.从木厂生产镁单质处循环
③从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你认为该化工厂还可以再增加的生产项目是 。
科目:高中化学 来源: 题型:阅读理解
海水是取之不尽用之不竭的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图。
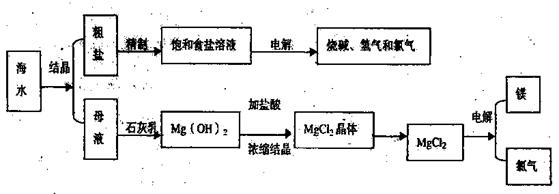
回答下列问题:
(1)请写出电解食盐水的离子方程式 。
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是: 。
②石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是 ;
③电解熔融氯化镁的化学方程式是 ;
④电解无水氯化镁所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可用作镁蒸气的冷却剂是(填写代号) 。
A.H2 B.Cl2 C.空气 D.O2
E.水蒸气
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入一种常见的气态氧化剂,又制取了重要的化工原料溴单质:
①生成溴单质的化学反应的离子方程式是
②以下是对生产溴单质所用的气态氧化剂寻找货源的主凤想,其中合理的是
(填写代号)
A.以外地购买 B.在当地新建生产厂
C.从本厂生产烧碱外循环 D.从木厂生产镁单质处循环
③从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你认为该化工厂还可以再增加的生产项目是 。
科目:高中化学 来源:不详 题型:填空题

科目:高中化学 来源: 题型:阅读理解
 (2010?西城区二模)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下.
(2010?西城区二模)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下.| 15 |
| 16 |
| ||
| △ |
| ||
| △ |
科目:高中化学 来源:同步题 题型:填空题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com