
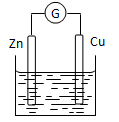
| 如下图所示装置,若要使装置中电流计的指针发生偏转,则向容器中加入的物质是 |
 |
A.植物油 B.酒精 C.蔗糖溶液 D.稀硫酸 |
科目:高中化学 来源:山东省期中题 题型:单选题
科目:高中化学 来源: 题型:
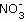
(1)实验过程中,观察到的主要现象是:
①_________________________________________________________________;
②_________________________________________________________________;
③_________________________________________________________________;
④_________________________________________________________________。
(2)欲使反应现象更明显,应向小烧杯中加入___________________。
A.粗铜片 b.纯铜片
如果反应中加入的是含少量铝的粗铜,则反应中形成无数微电池。请写出微电池中正极上的电极反应方程式_____________________________________________。
(3)用该装置做铜与浓硝酸反应的实验,最突出的优点是:_______________________。
(4)若要验证最终得到的气体生成物,最简便的方法是:__________________。
(5)工业上吸收NO和NO2的混合气体,常使用NaOH溶液。欲使NO和NO2被充分吸收,则NO和NO2的体积应满足_________________。(NO+NO2+2NaOH====2NaNO2+H2O)
A.V(NO)>V(NO2) b.V(NO)<V(NO2) c.V(NO)≤V(NO2)
科目:高中化学 来源: 题型:
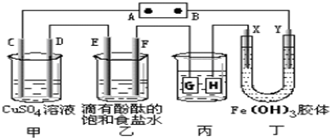
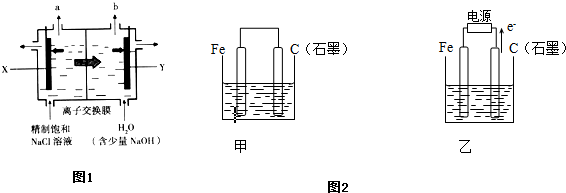
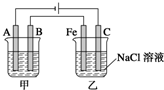 如图所示:甲、乙为相互串联的两电解池.试回答:
如图所示:甲、乙为相互串联的两电解池.试回答:科目:高中化学 来源: 题型:填空题
如图所示,某同学设计了一个燃料电池并探究氯碱工业的原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题: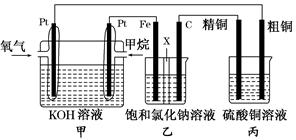
(1)甲烷燃料电池负极反应式为________________________。
(2)石墨(C)极的电极反应式为_______________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体的体积为________L;丙装置中阴极析出铜的质量为________ g。
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。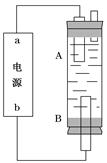
若用于制漂白液,a为电池的________极,电解质溶液最好用)________________
若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用________作电极。
科目:高中化学 来源: 题型:
在如右图所示的实验装置中,盛有足量水的水槽里放两个烧杯,小烧杯里放有适量铜片和过量浓硝酸,小烧杯外面倒扣一大烧杯,请回答下列问题:

(1)实验过程中,观察到的主要现象是:(4分,每空1分)
①____________________________________________________________________________;
②____________________________________________________________________________;
③____________________________________________________________________________;
④____________________________________________________________________________。
(2)欲使反应现象更明显,应向小烧杯中加入___________________。(1分)
A.粗铜片 b.纯铜片
如果反应中加入的是含少量铝的粗铜,则反应中形成无数微电池。请写出微电池中正极上的电极反应方程式_____________________________________________。(3分)
(3)用该装置做铜与浓硝酸反应的实验,最突出的优点是:_______________________。(2分)
(4)若要验证最终得到的气体生成物,最简便的方法是:__________________。(2分)
(5)工业上吸收NO和NO2的混合气体,常使用NaOH溶液。欲使NO和NO2被充分吸收,则NO和NO2的体积应满足_________________。(NO+NO2+2NaOH====2NaNO2+H2O)(3分)
A.V(NO)>V(NO2) b.V(NO)<V(NO2) c.V(NO)≤V(NO2)
科目:高中化学 来源:物理教研室 题型:058
请回答有关问题:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性?答:_ ______。
(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为:_____ ___。若在A中盛固体CaCO3,a中盛6mol/L的盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处装置(不必画图)和其中的试剂是:________、________。
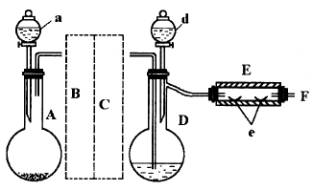
(3)实验时,装置D和E的橡胶塞最好用铅箔包住,原因是___ _____。
(4)反应过程中要不断通入CO2,其主要作用是①____ ____;②_____ ___ 。
(5)E中的反应为:2Fe+3Br![]()
![]() 2FeBr
2FeBr![]() ,2FeB
,2FeB![]()
![]() 2FeB
2FeB![]() r2+Br2
r2+Br2![]() ↑,则此实验中溴化亚铁的产率为________。
↑,则此实验中溴化亚铁的产率为________。
(6)为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
科目:高中化学 来源: 题型:阅读理解
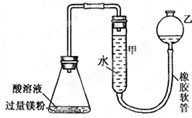 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH0.1 mol/L40.00mL | HCl溶液 0.1 mol/L 40.00mL |
5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| … | … | … | ||
| 65V×10-3 |
| 2ρSVm |
| 65V×10-3 |
| 2ρSVm |
科目:高中化学 来源:不详 题型:问答题
科目:高中化学 来源: 题型:
科目:高中化学 来源:不详 题型:问答题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com