
| 下列关于铝及其氧化物、氢氧化物与强酸反应的说法中,正确的是 |
A.都有水生成 B.反应后铝元素主要以Al3+的形式存在 C.都有氢气生成 D.反应后铝元素主要以AlO2-的形式存在 |
科目:高中化学 来源:月考题 题型:单选题
科目:高中化学 来源: 题型:
| A、铝在常温下不能与氧气反应 | B、铝在化学反应中容易失去电子,是氧化剂 | C、铝与盐酸或强碱溶液反应都能放出氢气 | D、氧化铝只能与酸反应,不能与碱反应 |
科目:高中化学 来源:2011-2012学年山东省青岛开发区高二(下)期末化学试卷(解析版) 题型:选择题
科目:高中化学 来源: 题型:单选题
科目:高中化学 来源: 题型:
下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。
 |
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________
(2)D与G反应的化学方程式_________________________
(3)反应②离子方程式__________________________
(4)F→M的操作方法_______________
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
(6)①X、Y均为短周期元素,X最外层电子数比C气体所含元素最外层电子少1个且不同周期,Y与X同主族,下列关于X、Y、C三元素说法正确的是__________
A 原子半径 X〈 Y〈 C B 离子半径 X〈 C〈 Y
C 非金属性 X〈 Y〈 C D 最高价氧化物对应水化物酸性 C 〉X 〉Y
E 氢化物沸点 X〈 Y〈 C
② 请写出X的氢化物中原子个数比为1:1的化合物的电子式_________
(7)D与G反应生成A的同时,还有另一种产物,工业上用铝土矿(主要成分为Al2O3、、SiO2、Fe2O3)提取其的工艺流程如下:
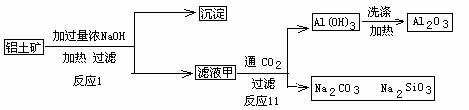 |
结合反应II,判断下列微粒结合质子(H+)的能力由强到弱的顺序是_________(填字母序号)
A. AlO2— B. OH— C. SiO32—
科目:高中化学 来源: 题型:
(1)试说明回收铝的过程中存在的困难。
(2)为什么金的回收率比铝的回收率要大得多?
(3)常温下,SiO2同强碱或强酸是很难反应的,现利用盐酸、氢氧化钠溶液、氮气、二氧化碳和水,从铝土矿中提取纯净的Al2O3。试设计一个适用于工业生产上提纯Al2O3的实验方案,用化学方程式表示提纯的过程。
(4)制取1 mol Al理论上需要多少库仑的电量(已知1 mol电子电量约为105C)?
(5)假定用6 V的直流电源进行电解,制2.7吨铝需要多少千焦的电能?(请列式并计算)
(6)在1.01×105 Pa,27 ℃时,每生产1 mol Al,理论上在阳极生成O2的体积为多少升?(请列式并计算)
(7)如果每度电的费用为0.60元,试计算生产厂家每生产1吨铝需付出的电费为多少元。(1度电=3 600 kJ)(请列式计算)
科目:高中化学 来源: 题型:
铝可以从铝土矿中获取,铝土矿是不纯净的铝的氧化物(杂质为Fe2O3和SiO2),它是非再生资源。假如我们对铝的消费保持现有速度,我们能获得生产足够的铝所需的铝土矿仅能维持30年左右。由此看来,保护现有自然资源和对非再生资源的再利用,是值得我们考虑的。但是在废物回收过程中,仍有相当大的难度,其关键的因素主要涉及旧金属的收集与其他废物的分离、回收和提炼金属的费用、金属本身的价值等。
(1)试说明回收铝的过程中存在的困难。
(2)为什么金的回收率比铝的回收率要大得多?
(3)常温下,SiO2同强碱或强酸是很难反应的,现利用盐酸、氢氧化钠溶液、氮气、二氧化碳和水,从铝土矿中提取纯净的Al2O3。试设计一个适用于工业生产上提纯Al2O3的实验方案,用化学方程式表示提纯的过程。
(4)制取1 mol Al理论上需要多少库仑的电量(已知1 mol电子电量约为105C)?
(5)假定用6 V的直流电源进行电解,制2.7吨铝需要多少千焦的电能?(请列式并计算)
(6)在1.01×105 Pa,27 ℃时,每生产1 mol Al,理论上在阳极生成O2的体积为多少升?(请列式并计算)
(7)如果每度电的费用为0.60元,试计算生产厂家每生产1吨铝需付出的电费为多少元。(1度电=3 600 kJ)(请列式计算)
科目:高中化学 来源:同步题 题型:填空题
科目:高中化学 来源: 题型:
(1)试说明回收铝的过程中存在的困难。
(2)为什么金的回收率比铝的回收率要大得多?
(3)常温下,SiO2同强碱或强酸是很难反应的,现利用盐酸、氢氧化钠溶液、氮气、二氧化碳和水,从铝土矿中提取纯净的Al2O3。试设计一个适用于工业生产上提纯Al2O3的实验方案,用化学方程式表示提纯的过程。
(4)制取1 mol Al理论上需要多少库仑的电荷量?
(5)假定用6 V的直流电源进行电解,制2.7吨铝需要多少千焦的电能?(请列式并计算)
(6)在1.01×105 Pa,27 ℃时,每生产1 mol Al,理论上在阳极生成O2的体积为多少升?(请列式并计算)
(7)如果每度电的费用为0.60元,试计算生产厂家每生产1吨铝需付出的电费为多少元。(1度电=3 600 kJ)(请列式计算)
科目:高中化学 来源: 题型:038
(1)试说明回收铝的过程中存在的困难。
(2)为什么金的回收率比铝的回收率要大得多?
(3)常温下,SiO2同强碱或强酸是很难反应的,现利用盐酸、氢氧化钠溶液、氮气、二氧化碳和水,从铝土矿中提取纯净的Al2O3。试设计一个适用于工业生产上提纯Al2O3的实验方案,用化学方程式表示提纯的过程。
(4)制取1 mol Al理论上需要多少库仑的电荷量?
(5)假定用6 V的直流电源进行电解,制2.7吨铝需要多少千焦的电能?(请列式并计算)
(6)在1.01×105 Pa,27 ℃时,每生产1 mol Al,理论上在阳极生成O2的体积为多少升?(请列式并计算)
(7)如果每度电的费用为0.60元,试计算生产厂家每生产1吨铝需付出的电费为多少元。(1度电=3 600 kJ)(请列式计算)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com