
科目:高中化学 来源: 题型:
 电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol/LNH3?H2O滴定10.00mL浓度均为0.100mol/L HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol/LNH3?H2O滴定10.00mL浓度均为0.100mol/L HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )科目:高中化学 来源:不详 题型:单选题
| A.①点溶液中C(H+)为0.200 mol/L |
| B.溶液温度在①时最高 |
| C.③点溶液中有c(C1-)>c(CH3COO-) |
| D.③点后因离子数目减,少使溶液电导率略降低 |
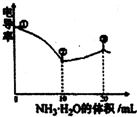
科目:高中化学 来源:2012-2013学年广西南宁二中高三(上)期中化学试卷(解析版) 题型:选择题
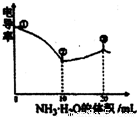
科目:高中化学 来源:不详 题型:单选题

| A.①点溶液中c(H+)为0.200 mol·L-1 |
| B.溶液温度高低为①>③>② |
| C.③点溶液中有c(Cl-)>c(CH3COO-) |
| D.③点后因离子数目减少使溶液电导率略降低 |
科目:高中化学 来源:2012届安徽省江南十校高三素质教育联考理科综合试卷化学部分(解析版) 题型:单选题
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()
滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()
A.①点溶液中C(H+)为 |
| B.溶液温度高低为①〉③〉② |
C.③点溶液中有 |
| D.③点后因离子数目减少使溶液电导率略降低 |
科目:高中化学 来源: 题型:单选题
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 mol·L-1 NH3·H2O溶液滴定10.00 mL浓度均为0.100 mol·L-1盐酸和CH3COOH溶液的混合溶液,所得曲线如图所示。下列说法正确的是( )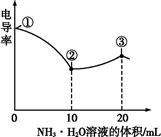
| A.①点溶液中c(H+)为0.200 mol·L-1 |
| B.溶液温度高低为①>③>② |
| C.③点溶液中有c(Cl-)>c(CH3COO-) |
| D.③点后因离子数目减少使溶液电导率略降低 |
科目:高中化学 来源: 题型:
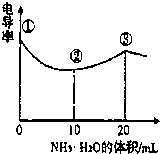 (2013?杭州一模)电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL 浓度均为0.100mol?L-1HCl和CH3COOH的混合液,电导率曲线如图所示.下列说法正确的是( )
(2013?杭州一模)电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL 浓度均为0.100mol?L-1HCl和CH3COOH的混合液,电导率曲线如图所示.下列说法正确的是( )科目:高中化学 来源: 题型:阅读理解
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| H | + 4 |
科目:高中化学 来源:2011年山东省烟台市高考化学模拟试卷(3月份)(解析版) 题型:解答题
 2Ni(OH)2
2Ni(OH)2

科目:高中化学 来源: 题型:
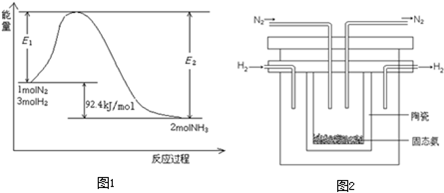
I.科学家一直致力于“人工固氮”的新方法研究。
(l)目前合成氨技术原理为:![]() △
△![]()
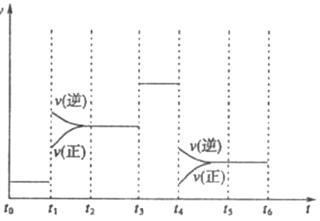 下图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
下图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为 ;![]() 时刻改变的反应条件是 。
时刻改变的反应条件是 。
②![]() 极易溶于水,其水溶液俗称氨水。用水稀释
极易溶于水,其水溶液俗称氨水。用水稀释![]() 的氨水,溶液中随着水量的增加而减小的是 (填序号)。
的氨水,溶液中随着水量的增加而减小的是 (填序号)。
![]()
![]()
![]()
![]()
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递![]() ),实现了高温常压下利用
),实现了高温常压下利用![]() 和
和![]() 电解合成氨。其阴极的电极反应式 。
电解合成氨。其阴极的电极反应式 。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,![]() 在催化剂(掺有少量
在催化剂(掺有少量![]() 的
的![]() )表面与水发生下列反应:
)表面与水发生下列反应:
![]() △
△![]() 进一步研究
进一步研究![]() 生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
| 303 | 313 | 323 |
| 4.8 | 5.9 | 6.0 |
①此合成反应的![]() 0,△
0,△![]() 0,(填“>”“<”或“=”)。
0,(填“>”“<”或“=”)。
②已知:![]() △
△![]() ;
;
![]() △
△![]()
则![]() △
△![]() = 。
= 。
II.已知可逆反应![]() (未配平)△
(未配平)△![]() 。温度为
。温度为![]() 时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图
时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图![]() 所示。
所示。
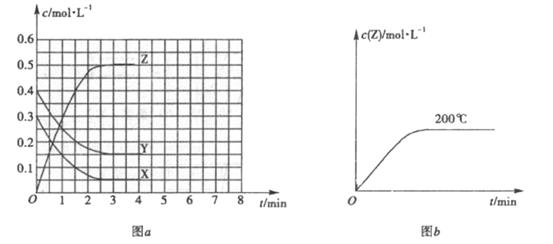
(1)![]() ℃时,该反应的平衡常数为
℃时,该反应的平衡常数为
(2)图![]() 为200℃时容器内
为200℃时容器内![]() 的变化曲线,请在图中补画该反应在100℃时的
的变化曲线,请在图中补画该反应在100℃时的![]() 的
的
变化曲线。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com