
科目:高中化学 来源: 题型:
科目:高中化学 来源: 题型:
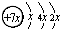 ,E的价层电子排布式为3d64s2.回答下列问题:
,E的价层电子排布式为3d64s2.回答下列问题:科目:高中化学 来源: 题型:
| A、原子半径:E>D>B>C>A | B、化合物BC与化合物DC中化学键类型相同 | C、A的含氢化合物的沸点一定低于C的含氢化合物的沸点 | D、EA2、EC2这两种化合物中,阳离子与阴离子个数比均为1:1 |
科目:高中化学 来源:2015届四川省资阳市高一下学期期末检测化学试卷(解析版) 题型:选择题
A、B、C、D、E五种元素原子序数依次增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是内层电子数的3倍,C、D原子的核外电子数之和与B、E原子的核外电子数之和相等。下列说法正确的是
A.原子最外层电子数:B<A
B.A与E形成的化合物是离子化合物
C.B与E可以形成EB2型化合物
D.最高价氧化物对应的水化物碱性:C<D
科目:高中化学 来源:2014届辽宁省高一下学期期中考试化学试卷(解析版) 题型:选择题
A、B、C、D、E五种元素原子序数依次增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是内层电子数的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是( )
A.原子最外层电子数:B<A
B.B与E可以形成EB2型化合物
C.A与E形成的化合物中含有离子键
D.最高价氧化物对应的水化物碱性:C<D
科目:高中化学 来源: 题型:单选题
A、B、C、D、E五种元素原子序数依次增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是内层电子数的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是
A.原子最外层电子数:B<A B.A与E形成的化合物是离子化合物
C.最高价氧化物对应的水化物碱性:C<D D.B与E可以形成EB2型化合物
科目:高中化学 来源: 题型:单选题
A、B、C、D、E五种元素原子序数依次增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是内层电子数的3倍,C、D原子的核外电子数之和与B、E原子的核外电子数之和相等。下列说法正确的是
A.原子最外层电子数:B<A
B.A与E形成的化合物是离子化合物
C.B与E可以形成EB2型化合物
D.最高价氧化物对应的水化物碱性:C<D
科目:高中化学 来源:不详 题型:单选题
| A.原子最外层电子数:B<A |
| B.B与E可以形成EB2型化合物 |
| C.A与E形成的化合物是离子化合物 |
| D.最高价氧化物对应的水化物碱性:C<D |
科目:高中化学 来源: 题型:
A、B、C、D、E五种元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2。C、D的电离能数据如下(kJ?mol―1):
| I1 | I2 | I3 | I4 | |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
(1)化合价是元素的一种性质。由C、D的电离能数据判断,C通常显 价,D显 价。
(2)某单质甲与化合物AB分子中电子总数相等,则甲分子中包含1个 键,2个 键。
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是 。
| 单键 | 双键 | 叁键 | ||
| AB | 键能/kJ?mol―1 | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能/kJ?mol―1 | 154.8 | 418.4 | 941.7 |
(4)E能与AB形成配合物,其中E提供 ,AB提供 。
科目:高中化学 来源:2008-2009学年浙江省宁波市高一(下)期末化学试卷(解析版) 题型:选择题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com