
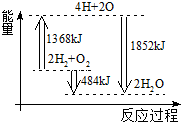
科目:高中化学 来源:不详 题型:单选题
| A.拆开2 mol H2(g)和1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ能量 |
| B.由H、O原子形成2 mol H2O(g),共吸收1852 kJ能量 |
| C.2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),共吸收484 kJ能量 |
| D.2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量 |
科目:高中化学 来源: 题型:
 (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理上可以设计成原电池的是
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理上可以设计成原电池的是
| ||
| ||
科目:高中化学 来源: 题型:
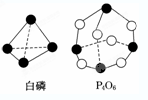 (1)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol 化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=198kJ/mol、E(P-O)=360kJ/mol、E(O═O)=498kJ/mol,则反应P4(白磷)燃烧生成P4O6的热化学方程式为
(1)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol 化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=198kJ/mol、E(P-O)=360kJ/mol、E(O═O)=498kJ/mol,则反应P4(白磷)燃烧生成P4O6的热化学方程式为科目:高中化学 来源: 题型:
 CH3OH(g)
CH3OH(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
科目:高中化学 来源:2015届湖北省高二上学期期中考试化学试卷(解析版) 题型:选择题
反应:2H2(g)+O2(g)===2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是( )
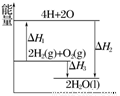
A.ΔH1<0 B.ΔH2为该反应的反应热
C.ΔH3不是H2的燃烧热 D.ΔH2=ΔH1+ΔH3
科目:高中化学 来源:2012-2013学年江苏省高三9月月测化学试卷(解析版) 题型:填空题
(16分)(1)已知:①N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
②4NH3(g)+5O2(g)= 4NO(g)+6H2O(g);△H=-905 kJ·mol-1
③2H2(g)十O2(g)=2H2O(g):△H=-483.6 kJ·mol-1
则N2(g)+3H2(g) 2NH3(g)的△H=
。
2NH3(g)的△H=
。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3)= ;②达到平衡时NH3的体积分数为 。
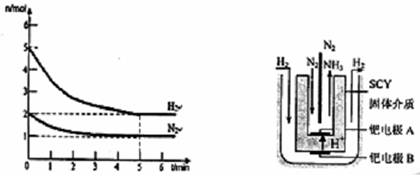
图1 图2 电解法合成氨装置
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 。
(4)草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C2O4、KHC2O4、K2C2O4 溶液的pH如下表所示。
|
|
H2C2O4 |
KHC2O4 |
K2C2O4 |
|
pH |
2.0 |
3.1 |
8.1 |
①用离子方程式表示KHC2O4呈酸性的原因:
②取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2SO4溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
a.完成离子方程式: C2O42-+ MnO4-+ H+ = CO2+ Mn2++ H2O。
b. 原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
科目:高中化学 来源: 题型:单选题
反应:2H2(g)+O2(g)===2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是( )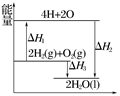
| A.ΔH1<0 | B.ΔH2为该反应的反应热 |
| C.ΔH3不是H2的燃烧热 | D.ΔH2=ΔH1+ΔH3 |
科目:高中化学 来源: 题型:填空题
(1)如图表示金刚石、石墨在相关反应过程中的能量变化关系。
写出石墨转化为金刚石的热化学方程式 。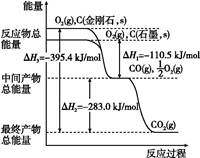
(2)已知:Ti(s)+2Cl2(g) TiCl4(l)ΔH="-804.2" kJ/mol
TiCl4(l)ΔH="-804.2" kJ/mol
2Na(s)+Cl2(g)="2NaCl(s)" ΔH="-882.0" kJ/mol
Na(s)="Na(l)" ΔH="+2.6" kJ/mol
则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的ΔH= kJ/mol。
(3)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH="-a" kJ/mol
②CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH="-b" kJ/mol
③H2O(g)=H2O(l) ΔH="-c" kJ/mol则:2CO(g)+O2(g) 2CO2(g)的ΔH= kJ/mol。
2CO2(g)的ΔH= kJ/mol。
(4)工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g)=CH3OH(g),下图表示反应过程中能量的变化情况。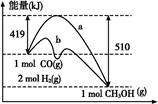
在图中,曲线 (填“a”或“b”)表示使用了催化剂;该反应属于 (填“吸热”或“放热”)反应。
科目:高中化学 来源: 题型:填空题
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l)=H2O(g) ΔH="+44.0" kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为___________ 。
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2=2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将_________能转化为___________能。其电极反应式分别为:
负极_________________________,正极_____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com