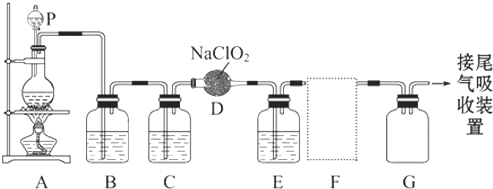
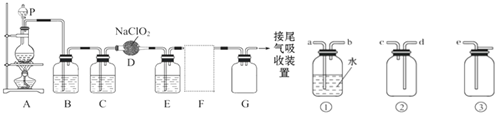
ClO
2作为一种广谱型的消毒剂,将逐渐用来取代Cl
2成为自来水的消毒剂.已知ClO
2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO
2的原理是用亚氯酸钠固体与氯气反应 2NaClO
2+Cl
2═2ClO
2+2NaCl.下图是实验室
用于制备和收集一定量较纯净的ClO
2的装置(某些夹持装置和垫持用品省略)其中E中盛有CCl
4液体(用于除去ClO
2中的未反应的Cl
2).
(1)仪器P的名称是
分液漏斗
分液漏斗
.
(2)写出装置A中烧瓶内发生反应的离子方程式:
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
.
(3)B装置中所盛试剂是
饱和食盐水
饱和食盐水
.
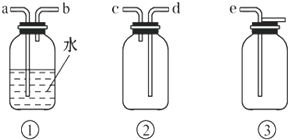
(4)F处应选用的收集装置是
②
②
(填序号),其中与E装置导管相连的导管口是
d
d
(填接口字母).
(5)G装置的作用是
防止吸收尾气的液体倒吸进入F
防止吸收尾气的液体倒吸进入F
.
(6)若用100mL 2mol?L-1的浓盐酸与足量的MnO
2制备Cl
2,则被氧化的HCl的物质的量是
C
C
(填序号).
A.>0.1mol B.0.1mol C.<0.1mol D.无法判断.