氧化还原反应在化学工业中应用广泛.
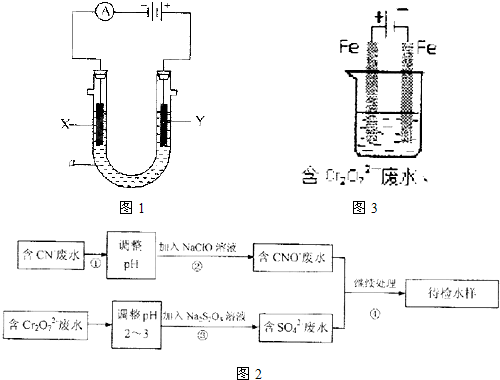
Ⅰ、有如图1所示的实验装置.
(1)若用石墨电极电解NaHCO
3溶液,Y电极上产生的气体是
O2
O2
.
(2)如要在铁上镀铜,则X电极的材料是
铁
铁
,Y电极反应式是
Cu-2e-=Cu2+
Cu-2e-=Cu2+
.
Ⅱ、某电镀铜厂有两种废水需要处理,一种废水中含有CN
-离子,另一种废水中含Cr
2O
72-离子.该厂拟定如图2所示的废水处理流程.
回答以下问题:
(1)②中使用的NaClO溶液呈碱性,原因是
ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
(用离子方程式表示).
(2)③中反应时,每0.4mol Cr
2O
72-转移2.4mole
-,该反应的离子方程式为
3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O
3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O
.
(3)取少量待检水样于试管中,加入过量NaOH溶液,有蓝色沉淀生成.向上述有蓝色沉淀的悬浊液中加入Na
2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少.请你使用化学用语,结合必要的文字说明分析其过程
待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
.
Ⅲ、工业可用电解法来处理含Cr
2O
72-废水.
(1)Fe
2+与酸性溶液中的Cr
2O
72-反应的离子方程式是
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
.
(2)实验室利用如图3所示模拟处理含Cr
2O
72-的废水(废水中加入适量NaCl以增加溶液的导电性),在阴极区得到金属氢氧化物沉淀.用平衡移动原理解释沉淀出现在阴极附近的原因
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
.
(3)用电解法处理该溶液中 0.01mol Cr
2O
72-时,得到沉淀的质量是
8.48
8.48
g.


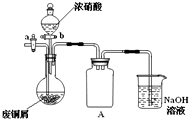 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.