
科目:高中化学 来源: 题型:
| A、用盐酸可以洗去铜表面的铜锈 | B、0.1mol?L-1的CuSO4溶液中,Cu2+的数目一定小于0.1NA | C、在CuCl2和FeCl3的混合溶液中加入铁粉,若有固体残留,则其中一定含有铜 | D、在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明K甲(CuS)远小于K甲(FeS) |
科目:高中化学 来源:2013-2014学年山东省临沂市高三3月教学质量检测(一模)化学试卷(解析版) 题型:选择题
下列有关含铜化合物的说法错误的是(设NA为阿伏加德罗常数的值)
A.用盐酸可以洗去铜表面的铜锈
B.0.1mol/L的CuSO4溶液中,Cu2+的数目一定小于0.1NA
C.在CuCl2和FeCl3的混合溶液中加入铁粉,若有固体残留,则其中一定含有铜
D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明Ksp(CuS)远小于Ksp(FeS)
科目:高中化学 来源: 题型:
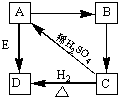 Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
| ||
| ||
| ||
| ||
科目:高中化学 来源: 题型:阅读理解
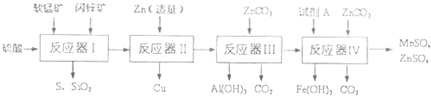
| 物质 | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com