
科目:高中化学 来源:不详 题型:单选题
| A.6.02×1023就是阿伏加德罗常数 |
| B.0.012kg12C含有的碳原子数就是阿伏加德罗常数 |
| C.含有阿伏加德罗常数个粒子的物质的量是1mol |
| D.1molNH3所含原子数约是2.408×1024 |
科目:高中化学 来源:不详 题型:单选题
| A.6.02×1023就是阿伏加德罗常数 |
| B.0.012kg12C含有的碳原子数就是阿伏加德罗常数 |
| C.含有阿伏加德罗常数个粒子的物质的量是1mol |
| D.1molNH3所含原子数约是2.408×1024 |
科目:高中化学 来源:2011-2012学年湖北省宜昌市长阳一中高一(上)期中化学试卷(解析版) 题型:选择题
科目:高中化学 来源:2011-2012学年安徽省巢湖市居巢区春晖学校高一(上)月考化学试卷(9月份)(解析版) 题型:选择题
科目:高中化学 来源: 题型:
下列关于阿伏加德罗常数NA的说法正确的是( )
A.在铜与硫的反应中,1mol铜失去的电子数为2NA。
B.Cu与足量浓HNO3反应转移NA电子生成的气体在标况下占22.4L(忽略气体溶解及逸散)。
C.31g白磷中含有P—P键的个数为4NA
D.足量Fe与一定量热的浓H2SO4反应放出l mol气体时转移的电子数为2NA(忽略气体溶解及逸散)。
【解析】硫的氧化性比较弱,和铜反应生成的是Cu2S,因此1mol铜失去的电子数为NA。铜和浓硝酸反应的方程式为3Cu+8HNO3=3Cu(NO3)2+4H2O+2NO2↑,即每生成2molNO2转移电子是6mol,因此选项B是错误的。白磷是正四面体结构,1个白磷分子中含有6个P-P键,31g白磷是![]() ,所以含有的P—P键为0.25mol×6=1.5mol,D不正确。因为铁是过量的,所以生成物是硫酸亚铁,即铁和浓硫酸反应的方程式为Fe+2H2SO4(浓)
,所以含有的P—P键为0.25mol×6=1.5mol,D不正确。因为铁是过量的,所以生成物是硫酸亚铁,即铁和浓硫酸反应的方程式为Fe+2H2SO4(浓)FeSO4+H2O+SO2↑,所以选项D是正确的。答案选D。
科目:高中化学 来源:2014届河北省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于阿伏加德罗常数NA的说法正确的是( )
A.在铜与硫的反应中,1mol铜失去的电子数为2NA。
B.Cu与足量浓HNO3反应转移NA电子生成的气体在标况下占22.4L(忽略气体溶解及逸散)。
C.31g白磷中含有P—P键的个数为4NA
D.足量Fe与一定量热的浓H2SO4反应放出l mol气体时转移的电子数为2NA(忽略气体溶解及逸散)。
【解析】硫的氧化性比较弱,和铜反应生成的是Cu2S,因此1mol铜失去的电子数为NA。铜和浓硝酸反应的方程式为3Cu+8HNO3=3Cu(NO3)2+4H2O+2NO2↑,即每生成2molNO2转移电子是6mol,因此选项B是错误的。白磷是正四面体结构,1个白磷分子中含有6个P-P键,31g白磷是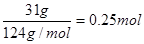 ,所以含有的P—P键为0.25mol×6=1.5mol,D不正确。因为铁是过量的,所以生成物是硫酸亚铁,即铁和浓硫酸反应的方程式为Fe+2H2SO4(浓)
,所以含有的P—P键为0.25mol×6=1.5mol,D不正确。因为铁是过量的,所以生成物是硫酸亚铁,即铁和浓硫酸反应的方程式为Fe+2H2SO4(浓) FeSO4+H2O+SO2↑,所以选项D是正确的。答案选D。
FeSO4+H2O+SO2↑,所以选项D是正确的。答案选D。
科目:高中化学 来源:2011-2012学年浙江省嘉兴一中高二上学期期中考试化学试卷 题型:单选题
下列关于阿伏加德罗常数(NA)的说法中正确的是
| A.2.4克Mg由原子变为离子, 共失去的电子数为0.1NA |
| B.1.7克H2O2中所含有的电子数为0.9NA |
| C.相同质量的NO2和N2O4所含的原子数不同 |
| D.在20℃, 1.01×105Pa时, 11.2L O2与H2的混合气体所含原子数为NA |
科目:高中化学 来源:不详 题型:单选题
| A.2.4克Mg由原子变为离子, 共失去的电子数为0.1NA |
| B.1.7克H2O2中所含有的电子数为0.9NA |
| C.相同质量的NO2和N2O4所含的原子数不同 |
| D.在20℃, 1.01×105Pa时, 11.2L O2与H2的混合气体所含原子数为NA |
科目:高中化学 来源: 题型:单选题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com