
科目:高中化学 来源:西城区模拟 题型:单选题
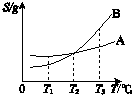
| A.T1℃时,A、B饱和溶液中,A溶液的溶质的质量分数较小 |
| B.T2℃时,A、B饱和溶液的物质的量浓度相等 |
| C.T1℃时A、B的饱和溶液升至T3℃时,B溶液的溶质的质量分数较大 |
| D.可用加热浓缩、降温结晶的方法除去B中混有的少量A |
科目:高中化学 来源:2010年北京市西城区高考适应性练习化学试卷(3月份)(解析版) 题型:选择题

科目:高中化学 来源: 题型:单选题
 物质A、B的溶解度曲线如右图所示(A、B均不与水反应且不含结晶水).下列叙述中,正确的是
物质A、B的溶解度曲线如右图所示(A、B均不与水反应且不含结晶水).下列叙述中,正确的是科目:高中化学 来源:2014届浙江省杭州市高一上学期期中七校联考化学试卷 题型:选择题
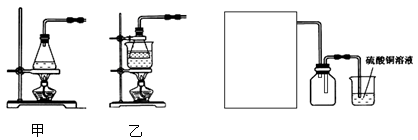
(12分)在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
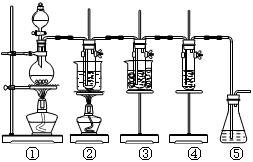
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为 ▲ 。
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是: ▲ 。A.NaBiO3 B.FeCl3 C.PbO2 D.Na2O2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
 (3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ▲ ; ② ▲ 。
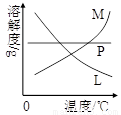
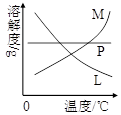
(4)反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 ▲ (填写编号字母);从②的试管中分离出该晶体的方法是 ▲ (填写实验操作名称)。
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性 ▲ 。
为什么? ▲ 。
(6)若②的试管溶液中不但有KClO3生成还有KClO生成,且二者的物质的量之比为1∶2,则该反应中氧化剂和还原剂的物质的量之比为: ▲ 。
科目:高中化学 来源: 题型:
(12分)在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为 ▲ 。
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是: ▲ 。A.NaBiO3 B.FeCl3 C.PbO2 D.Na2O2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
 (3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ▲ ; ② ▲ 。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 ▲ (填写编号字母);从②的试管中分离出该晶体的方法是 ▲ (填写实验操作名称)。
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性 ▲ 。
为什么? ▲ 。
(6)若②的试管溶液中不但有KClO3生成还有KClO生成,且二者的物质的量之比为1∶2,则该反应中氧化剂和还原剂的物质的量之比为: ▲ 。
科目:高中化学 来源: 题型:
在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为 。
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是: 。A.NaBiO3 B.FeCl3 C.PbO2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>FeCl3
 (3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ; ② 。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性 。为什么? 。
(6)一定量的氢气在氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-离子的物质的量 。
科目:高中化学 来源:浙江省模拟题 题型:实验题
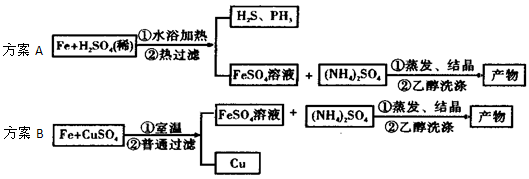
科目:高中化学 来源: 题型:
(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
装置如右图,写出阳极发生的电极反应式 ▲ 、
▲ 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.5 |
(1)写出步骤①发生反应的离子方程式 ▲ 。
(2)步骤②中可加入 ▲ (填化学式)调节溶液pH至 ▲ (填范围)。
(3)步骤③不能蒸干的原因是 ▲ 。
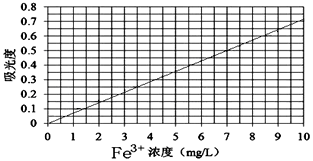
(4)右图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 ▲ 。
A.无水乙醇 B.蒸馏水
C.95%乙醇溶液 D.饱和硫酸钠溶液
(5)操作1的名称是 ▲ 。
科目:高中化学 来源:2012届浙江省台州市高二下学期期末测试化学 题型:选择题
(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
装置如右图,写出阳极发生的电极反应式 ▲ 、
▲ 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)

已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
|
离子 |
开始沉淀的pH |
完全沉淀的pH |
|
Fe2+ |
6.4 |
8.4 |
|
Fe3+ |
2.4 |
3.1 |
|
Cu2+ |
5.2 |
6.5 |
(1)写出步骤①发生反应的离子方程式 ▲ 。
(2)步骤②中可加入 ▲ (填化学式)调节溶液pH至 ▲ (填范围)。
(3)步骤③不能蒸干的原因是 ▲ 。

(4)右图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 ▲ 。
A.无水乙醇 B.蒸馏水
C.95%乙醇溶液 D.饱和硫酸钠溶液
(5)操作1的名称是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com