
科目:高中化学 来源:2009-2010学年湖北省黄冈中学高一(下)期中化学试卷(解析版) 题型:选择题
科目:高中化学 来源:0117 期中题 题型:单选题
科目:高中化学 来源:2011-2012学年上海市重点中学高二(下)期末化学试卷(解析版) 题型:解答题
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 | 密度:0.97g?cm-3 熔点:97.8℃ 能导电 | 沸点:-34.0℃ 不能导电 | 密度:1.43g?L-1 沸点:-183.0℃ 不能导电 | 熔点:3550℃ 能导电 |
科目:高中化学 来源: 题型:阅读理解
二十世纪以来,人们发现,引起元素性质周期性变化的本质原因不是相对原子质量的递增,而是核电荷数(原子序数)的递增,也就是核外电子排布的周期性变化。后来,科学家又对元素周期表作了许多改进,如增加了0族等,把元素周期表修正为现在的形式。
根据以上材料,完成下列问题:
(1)门捷列夫提出元素周期律,研究元素性质的周期性变化时,主要是按下列叙述中的哪个顺序排列的?__________。
A.原子序数的递增 B.相对原子质量的递增
C.核外电子排布 D.质子数的递增
(2)元素周期律的真正基础不是元素的相对原子质量,而是原子序数。你是如何解释后者比前者更合理的?__________________________________________
(3)门捷列夫提出的元素周期律的基础虽然不是最科学的,但也解释和预测了许多事实,你认为最可能的原因是什么?__________________________________________
科目:高中化学 来源:2012-2013学年四川省凉山州高三第三次诊断理综化学试卷(解析版) 题型:推断题
下表为元素周期表的一部分,请参照元素在表中的位置,回答下列问题(凡能用化学用语的必须用相应的化学用语回答):
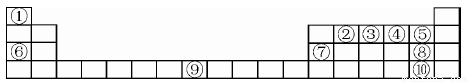
(1)用原子符号表示中子数为8的编号为③的原子____,以上元素中原子的电子层数等于最外层电子数的元素为____,⑤、⑥、⑦、⑧三元素的简单离子半径由大到小的顺序为 。
(2)②①④三种元素能按原子个数比1:2:1形成一种在室内装修过程中常见的气体污染物。该气体分子的中心原子的杂化轨道类型为____,1mol该分子中π键的数目为____。
(3)写出⑥的单质在④的单质中燃烧产生的化合物的电子式 ,该化合物与足量⑨的低价硫酸盐溶液反应的离子方程式 。
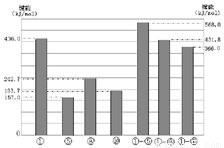
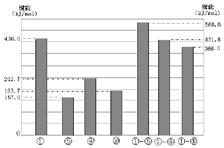
(4)同主族元素的单质及化合物在许多性质上都存在着递变规律。下图是①、⑤、⑧、⑩的单质及①分别和⑤、⑧、⑩形成的化合物的键能大小。
由图中键能数据推断得知:①—R键(R表示⑤、⑧、⑩)的键能随分子中键长的增长而 (填“增大”或“减小”)。同主族元素随着原子序数的递增,非金属元素的单质分子中化学键的键长逐渐增大,键能____(填“一定减小”或“不一定减小”)根据图中键能数据,写出①的气态单质在⑧的气态单质中燃烧的热化学方程式____。
科目:高中化学 来源:不详 题型:推断题

科目:高中化学 来源: 题型:阅读理解
| 实验方案 | 实验现象 |
| 1,用砂纸打磨后的镁条与沸水反应,再向反应液中滴加酚酞 2,向新制的H2S饱和溶液中滴加新制的氯水 3,钠与滴有酚酞试液的冷水反应 4,镁条与amol/L的盐酸反应 5,铝条与bmol/L的盐酸反应 6,向AlCl3溶液中滴加NaOH溶液至过量 |
I.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 I I.放出无色气体,气体可燃,溶液变浅红色 III.反应不十分强烈,产生的气体可燃 IV.剧烈反应,产生的气体可燃 V.生成白色絮状沉淀,继而沉淀消失 VI.生成淡黄色沉淀 |
科目:高中化学 来源: 题型:阅读理解
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 |
密度:0.97g?cm-3 熔点:97.8℃ 能导电 |
沸点:-34.0℃ 不能导电 |
密度:1.43g?L-1 沸点:-183.0℃ 不能导电 |
熔点:3550℃ 能导电 |
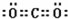
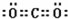
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com