
科目:高中化学 来源:2009-2010学年广东省广州市执信中学高二(下)期中化学试卷(文)(解析版) 题型:选择题
科目:高中化学 来源: 题型:阅读理解
| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
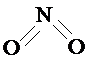 和
和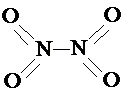 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式科目:高中化学 来源: 题型:阅读理解
(I)多项选择题
关于化工生产的下列叙述中,正确的是 。
A.生产普通玻璃的原料是石灰石、石英、纯碱,在玻璃熔炉中发生复杂的物理化学变化
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.加热法只适用于软化暂时硬度的硬水
D.工业上采用电解熔融氯化铝生产金属铝
E.用高纯度焦炭与石英砂反应可制得纯度达到9个9的单晶硅材料
(II)
工业上制取硝酸铵的流程图如下,请回答下列问题:?
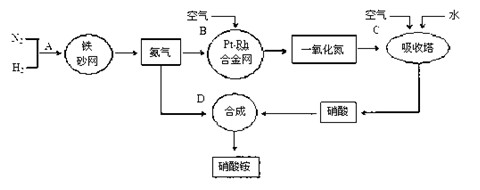
(1)1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:
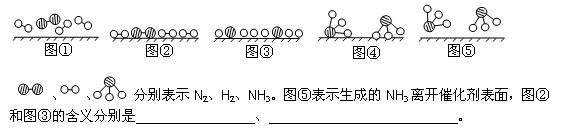
(2)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
 碱液吸收法:NO+NO2+2NaOH===2NaNO2+H2O
碱液吸收法:NO+NO2+2NaOH===2NaNO2+H2O
NH3还原法:8NH3+6NO2 ======= 7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(5)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表。
| 注意事项 | 理由 | |
| ① | ||
| ② |
科目:高中化学 来源: 题型:填空题
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。推断A—W物质各是什么,回答下列问题。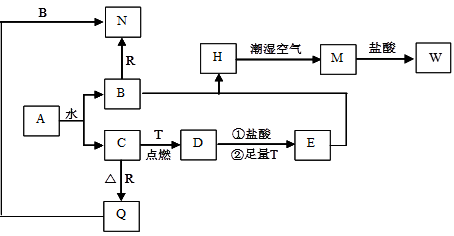
(1)写出下列物质的化学式:D: N: 。
(2)A和水的反应属于下列何种反应类型 (填序号)。
A.化合反应 B.氧化还原反应 C.离子反应 D.置换反应
(3)若要确定E溶液中是否含有W物质,所选试剂为 (填序号)。
A.氯水和KSCN溶液 B.KSCN溶液
C.浓氨水 D.酸性高锰酸钾溶液
(4)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: ;
(5)B和R反应生成N的离子方程式: ;
M→W的离子方程式: ;
科目:高中化学 来源:不详 题型:填空题

科目:高中化学 来源: 题型:
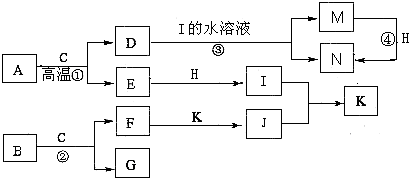
科目:高中化学 来源: 题型:阅读理解
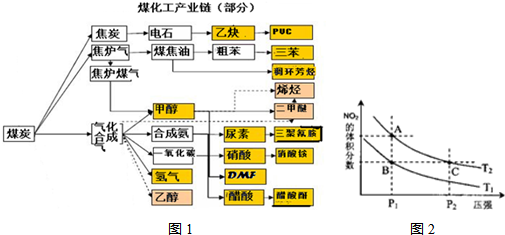
(13分)实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)该产业链中属于高中阶段常见的在低温下能自发进行的反应是:
(2)已知该产业链中某反应的平衡表达式为:
它所对应的化学反应为:
(3)已知在一定温度下,
C(s)+CO2(g) 2CO(g)平衡常数K1;
CO(g)+H2O(g H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g) CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是: 。
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: 。
(5)从上图看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g) 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(6)0.2mol/L的NaOH与0.4mol/L的上述产业链中一产品化肥硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是 。
科目:高中化学 来源:2011-2012学年浙江省高三上学期期末考试化学试卷 题型:填空题
(13分)实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
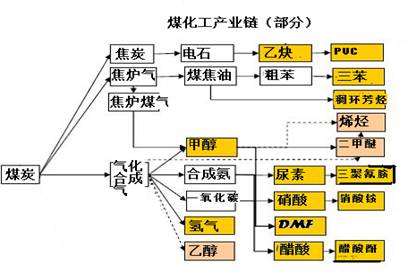
(1)该产业链中属于高中阶段常见的在低温下能自发进行的反应是:
(2)已知该产业链中某反应的平衡表达式为: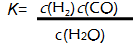
它所对应的化学反应为:
(3)已知在一定温度下,
C(s)+CO2(g) 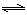 2CO(g)平衡常数K1;
2CO(g)平衡常数K1;
CO(g)+H2O(g 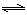 H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)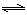 CO(g)+H2(g) 平衡常数K3;
CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是: 。
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) 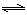 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: 。
(5)从上图看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g) 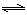 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(6)0.2mol/L的NaOH与0.4mol/L的上述产业链中一产品化肥硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com