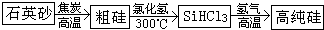晶体硅是一种重要的非金属材料.请写出晶体硅的二种用途:
计算机芯片
计算机芯片
、
太阳能电池
太阳能电池
.制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl
3(常温下为液态,易挥发)
③SiHCl
3与过量H
2在1000~1100℃反应制得纯硅.
已知:
Ⅰ.SiHCl
3水解会生成两种气态产物,请写出其水解的化学方程式:
SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑
SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑
.
Ⅱ.SiHCl
3 在空气中自燃.请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
.
(2)用SiHCl
3与过量H
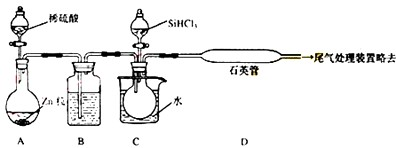
2反应制备纯硅的装置如下(热源及夹持装置略去)
①装置B中的试剂是
浓H2SO4
浓H2SO4
,装置C中的烧瓶需要加热,其目的是
使SiHCl3气化
使SiHCl3气化
;
②反应一段时间后,装置D中观察到的现象是
D石英管的内壁附有灰黑色晶体
D石英管的内壁附有灰黑色晶体
,装置D中发生反应的化学方程式为
;
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
先通一段时间H2,将装置中的空气排尽
先通一段时间H2,将装置中的空气排尽
;
④设计鉴定产品硅中是否含少量Fe单质的方法:
取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若出现红色说明含Fe,若不出现红色说明不含Fe.
取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若出现红色说明含Fe,若不出现红色说明不含Fe.
.