
科目:高中化学 来源:2011-2012学年广东省实验中学高二(上)期末化学试卷(文科)(解析版) 题型:选择题
科目:高中化学 来源:2007新课标高一化学同步测试 第四节 硫酸、硝酸和氨(A) 题型:013
|
有关硫酸的下列化学反应中,不是表现硫酸氧化性的是 | |
| [ ] | |
A. |
浓硫酸与铝的反应 |
B. |
浓硫酸与木炭的反应 |
C. |
稀硫酸与锌的反应 |
D. |
稀硫酸与纯碱的反应 |
科目:高中化学 来源:志鸿系列训练必修一化学人教版 人教版 题型:013
|
有关硫酸的下列化学反应中,不是表现硫酸氧化性的是 | |
| [ ] | |
A. |
浓硫酸与铝的反应 |
B. |
浓硫酸与木炭的反应 |
C. |
稀硫酸与锌的反应 |
D. |
稀硫酸与纯碱的反应 |
科目:高中化学 来源: 题型:阅读理解
科目:高中化学 来源: 题型:阅读理解
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
![]() (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
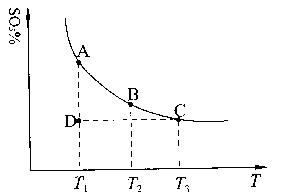
![]() ①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或
“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,![]()
![]() (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
 (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母a、b的代数式表示)②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时![]() )
)
科目:高中化学 来源: 题型:
硫酸具有以下A~F的性质:A.酸性 B.高沸点难挥发 C.吸水性 D.脱水性 E.强氧化性 F.溶于水放出大量热
(1)浓硫酸与铜共热发生反应的化学方程式为____________。实验中往往有大量白色固体析出,可见浓硫酸在该实验中表现了哪些性质:____________。(浓硫酸性质用A、B、C、D、E、F填空,下同)
(2)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为__________________________________。硫酸在该反应中表现了哪些性质:____________________________。
(3)在过氧化氢跟稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式:____________。与(2)中反应比较反应条件不同的原因是____________。
(4)蔗糖晶体中滴2~3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味气体产生。写出产生有刺激气味气体的化学方程式:____________________________。该实验中浓硫酸表现的性质有____________________。
(5)工业制备CuSO4溶液采用实验(2)的原理而没有采用实验(1)和(3)的原理,是因为(1)和(3)有某些缺点,请你列举(1)和(3)分别有哪此缺点:实验(1)____________________________;实验(3)____________________________。
科目:高中化学 来源:山东省济南市2010届高三第一次模拟考试化学试卷 题型:单选题
(14分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: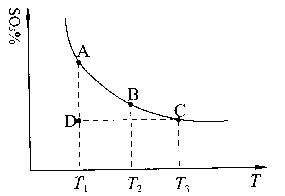
 ①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或
“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,
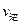 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母a、b的代数式表示)②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com