
科目:高中化学 来源: 题型:
除去下列物质中所含少量杂质的所选试剂不正确的是( )
|
科目:高中化学 来源:不详 题型:问答题
| 物 质 | 杂 质 | 试 剂 | |
| A | Cl2 | HCl | 饱和食盐水 |
| B | CO2 | HCl | 饱和Na2CO3溶液 |
| C | 金属镁 | 金属铝 | 稀NaOH溶液 |
| D | FeCl2 | FeCl3 | 铁粉 |
| A.A | B.B | C.C | D.D |
科目:高中化学 来源:2012-2013学年福建省泉州一中高三(上)期中化学试卷(解析版) 题型:选择题
| 物 质 | 杂 质 | 试 剂 | |
| A | Cl2 | HCl | 饱和食盐水 |
| B | CO2 | HCl | 饱和Na2CO3溶液 |
| C | 金属镁 | 金属铝 | 稀NaOH溶液 |
| D | FeCl2 | FeCl3 | 铁粉 |
科目:高中化学 来源: 题型:单选题
| 物 质 | 杂 质 | 试 剂 | |
| A | Cl2 | HCl | 饱和食盐水 |
| B | CO2 | HCl | 饱和Na2CO3溶液 |
| C | 金属镁 | 金属铝 | 稀NaOH溶液 |
| D | FeCl2 | FeCl3 | 铁粉 |
科目:高中化学 来源: 题型:
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和方法不正确的是
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 碳酸钠溶液 | 分液 |
| D | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
科目:高中化学 来源: 题型:013
除去下列物质中含有的少量杂质(括号内物质为杂质), 所选用试剂不正确的是
[ ]
A. CO2(SO2):饱和NaHCO3溶液
B. CH3COOCH2CH3(CH3COOH):饱和Na2CO3溶液
C. 苯(苯酚):溴水
D. CH3CH2OH(H2O):新制CaO
科目:高中化学 来源: 题型:
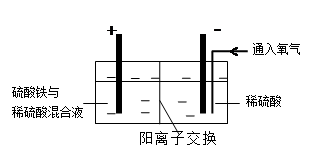
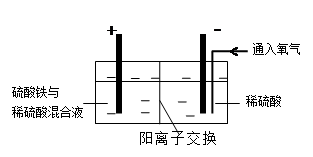
电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,若用硫酸铜溶液作电解液,粗铜接电源 极,电极反应为 ;通电一段时间后,溶液中铜离子浓度将 (增大,不变,减少)。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总离子反应
式为 ;电解时所需的精制食盐水,通常在粗盐水
加入某些试剂(现提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液来、BaCl2
溶液、Ba(NO3)2溶液、盐酸)除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,选出试剂,
按滴加的先后顺序为 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离
子交换膜法电解饱和食盐水原理示意图。
|
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2mol NaOH
D.向电解后的阴极溶液中加适量盐酸,可以
恢复到电解前的物质的浓度
科目:高中化学 来源:不详 题型:填空题
|
| A.从E口逸出的气体是H2 |
| B.从B中加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4L Cl2,便产生2mol NaOH |
| D.向电解后的阴极溶液中加适量盐酸,可以 |
科目:高中化学 来源: 题型:填空题
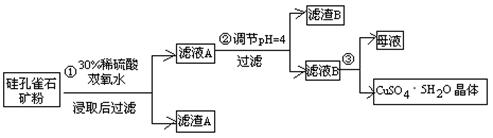
(15分)硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图: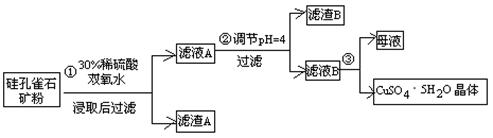
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
 R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)科目:高中化学 来源:不详 题型:填空题
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
 R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com