
科目:高中化学 来源:2012-2013学年广西北海市合浦县高二(上)期中化学试卷(文科)(解析版) 题型:选择题
科目:高中化学 来源:2011-2012学年江苏省如皋中学高二上学期质量检测化学试卷(必修) 题型:填空题
某盐溶液中可能含有NH4+、Ba2+、Na+、Fe2+、Cl—、CO32—、NO3—七种离子中的数种。某同学取4份此溶液样品,分别进行了如下实验:(硝酸具有强氧化性,可以氧化Fe2+、I-、S2-、SO32—等等)
①用pH试纸测得溶液呈强酸性;
②加入 过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
③加入硝酸酸化的AgNO3溶液产生白色沉淀;
④加足量BaCl2溶液,没有沉淀产生,在溶液中加入氯水,再滴加KSCN溶液,显红色
该同学最终确定在上述七种离子中肯定含有NH4+、Fe2+、Cl—三种离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A.①②④ B.①② C.①②③④ D.②③④
(1)(3分)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是 (填字母)。
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。从化学成分看,纤维素是一种 (填字母)。
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗 (填字母)。
A.麻黄碱 B.阿司匹林 C.抗酸药
(2)(5分)材料是人类赖以生存和发展的重要物质基础。
①生产硅酸盐水泥和普通玻璃都需用到的共同的主要原料是 。
②生活中有大量的铝制品。 家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
③有机玻璃受热时会软化, 易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为
易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为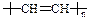 ,则其单体的结构简式为 。
,则其单体的结构简式为 。
(3)(7分)保护环境、保护地球是人类共同的呼声。
①向煤中加入石灰石作为脱硫剂,可以减少煤燃烧时产生的SO2。发生反应的化学方程式为 。
②天然水中含有的细小悬浮颗粒可以用 做混凝剂(写名称)进行净化处理。工业废水中含有的Cr3+离子,可用熟石灰作沉淀剂,在pH为8~9时生成沉淀而除去,该反应的离子方程式是 。
③城市餐饮业会产生大量污染环境的“地沟油”。“地沟油”的主要成分是油脂。综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取甘油和 。生活中会产生大量废弃塑料,将废弃塑料进行 处理,可以获得乙烯、丙烯等化工原料。
科目:高中化学 来源:不详 题型:填空题
 过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;

 家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。 易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为
易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为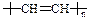 ,则其单体的结构简式为 。
,则其单体的结构简式为 。科目:高中化学 来源: 题型:解答题
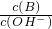 b.
b.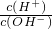 c.c(H+)?c(OH-) d.n(OH-)
c.c(H+)?c(OH-) d.n(OH-)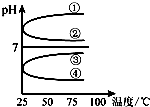
科目:高中化学 来源:2012年陕西省西工大附中高考化学一模试卷(解析版) 题型:解答题
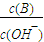 b.
b.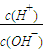 c.c(H+)?c(OH-) d.n(OH-)
c.c(H+)?c(OH-) d.n(OH-)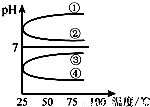
科目:高中化学 来源: 题型:
(1)用K2Cr2O7可以制备检验司机是否酒后开车的装置。现象是_______________________。
另一方面,铬对环境造成污染。其中,Cr(Ⅵ)的毒性比Cr(Ⅲ)毒性强200倍。制革厂排放的污染中约有1/3是有机物,其余是大量的含铬物质,直接排放污泥会对环境造成污染。1996年,外国科学家研究成功了一种技术,它较好地解决了制革厂废物利用与环境保护问题。工艺流程如下:
Ⅰ.污泥与普通黏土以一定比例混合(污泥占25%—30%)后制成砖坯,在窑中850—
Ⅱ.灼烧前期向窑中鼓入补充了氧气的空气。
Ⅲ.灼烧后期改用普通空气,且故意限制入窑空气的数量,使呈缺氧状态。烧制完成后,直到窑温降至
(2)前期鼓入富氧空气的原因是__________________________________________________。
(3)后期限制空气流入量的原因是_________________________________________________。
科目:高中化学 来源:2010年湖北省武汉市武昌区高三五月调研测试理综化学试题 题型:填空题
(15分)氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
I.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式_____。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示)_______________。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。
写出上述化学反应方程式:_________________________。 II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
(4)下列能表明容器乙一定达平衡状态的是_____(填字母)
| A.容器内的混合气体的平均相对分子质量不再变化 | |
| B.容器内的氮元素的质量不再变化 | |
C.氢气的生成速率与氨气的消耗速率之比为2:3 | D.形成1mol N N键的同时形成6molN—H键 |
科目:高中化学 来源: 题型:
氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
Ⅰ.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式______。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示) 。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。写出上述化学反应方程式:_____________________________________________________。
Ⅱ.在恒温条件下,起始时容积均为5 L的甲、乙两密闭容器中(甲为恒容容器、 乙为恒压容器),均进行反应:N2+3H2![]() 2NH3,有关数据及平衡状态特点见下表。
2NH3,有关数据及平衡状态特点见下表。
| 容器 | 起始投入 | 达平衡时 | ||
| 甲 | 2 mol N2 | 3 mol H2 | 1.5 mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 1.2 mo l NH3 | |
(4)下列能表明容器乙一定达平衡状态的是____________(填字母)
A.容器内的混合气体的平均相对分子质量不再变化
B.容器内的氮元素的质量不再变化
C.氢气的生成速率与氨气的消耗速率之比为2∶3
D.形成1 mol N≡N键的同时形成6 mol N—H键
(5)甲容器中氮气的转化率为 。
(6)起始时,容器乙是容器甲压强的_________倍。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com